Các em đã biết tính chất hóa học của axit nitric là thể hiện tính oxi hóa và được ứng dụng phần lớn trong điều chế phân đạm NH4NO3,… ngoài ra còn sử dụng trong sản xuất thuốc nổ, thuốc nhuộm, dược phẩm,…
Còn Muối nitrat có tính chất hóa học và tính chất vật lý như thế nào? được ứng dụng gì trong đời sống thực tế? chúng ta sẽ đi tìm hiểu trong bài viết này.
This post: Tính chất hóa học của Muối Nitrat và Bài tập vận dụng – Hóa 11 bài 9
I. Tính chất vật lý và hóa học của muối Nitrat
1. Tính chất vật lý của muối Nitrat
– Tất cả các muối nitrat đều tan nhiều trong nước và là chất điện li mạnh.
2. Tính chất hóa học muối Nitrat
• Phản ứng nhiệt phân: Các muối nitrat kém bền với nhiệt, chúng bị phân hủy khi đun nóng
– Muối nitrat của các kim loại hoạt động mạnh đứng trước Mg (kali, natri,…) bị phân hủy thành muối nitrit và oxit
* Ví dụ: 2KNO3 ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632373097x2rhaq8q9f_1632381881.gif) 2KNO2 + O2↑
2KNO2 + O2↑
– Muối nitrat của kim loại từ Mg đến Cu bị phân hủy thành oxit kim loại tương ứng, NO2 và O2
* Ví dụ: 2Cu(NO3)2 ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632373097x2rhaq8q9f_1632381881.gif) 2CuO↓ + 4NO2 + O2
2CuO↓ + 4NO2 + O2
– Muối nitrat của kim loại kém hoạt động (Sau Cu) bị phân hủy thành kim loại tương ứng, khí NO2 và O2.
* Ví dụ: 2AgNO3 ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632373097x2rhaq8q9f_1632381881.gif) 2Ag↓ + 2NO2↑ + O2↑
2Ag↓ + 2NO2↑ + O2↑

3. Cách nhận biết ion nitrat
– Trong môi trường trung tính, ion NO3– không có tính oxi hóa.
– Trong môi trường axit, ion NO3– thể hiện tính oxi hóa giống như HNO3.
– Để nhận biết ion NO3– trong dung dịch, người ta thêm một ít vụn đồng và dung dịch H2SO4 loãng vào rồi đun nóng nhẹ hỗn hợp.
Phản ứng tạo thành dung dịch màu xanh, khí NO không màu thoát ra bị oxi của không khí oxi hóa thành khí NO2 màu nâu đỏ.
3Cu +8H+ + 2NO3– ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632373097x2rhaq8q9f_1632381881.gif) 3Cu2+ + 2NO↑ + 4H2O (dd màu xanh)
3Cu2+ + 2NO↑ + 4H2O (dd màu xanh)
2NO + O2(kk) → 2NO2 (màu nâu đỏ)
– Muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm): NH4NO3; NaNO3, KNO3, Ca(NO3)2.
– Kali nitrat còn được sử dụng để chế thuốc nổ đen (thuốc nổ có khói) chứa 75% KNO3, 10% S và 15% C.
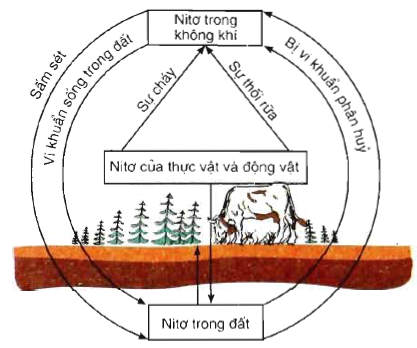 chu trình của nitơ trong tự nhiên
chu trình của nitơ trong tự nhiên
II. Bài tập vận dụng về muối Nitrat
* Bài 2 trang 45 sgk hoá 11: Lập các phương trình hoá học
a) Ag + HNO3, đặc → NO2↑ + ? + ?
b) Ag + HNO3, loãng → NO↑ + ? + ?
c) Al + HNO3 → N2O↑ + ? + ?
d) Zn + HNO3 → NH4NO3↑ + ? + ?
e) FeO + HNO3 → NO↑ + Fe(NO3)3 + ?
f) Fe3O4 + HNO3 → NO↑ + Fe(NO3)3 + ?
* Lời giải Bài 2 trang 45 sgk hoá 11:
– Ta có các PTPƯ sau (cân bằng PTPƯ bằng phương pháp Electron):
a) Ag + 2HNO3, đặc → NO2↑ + AgNO3 + H2O
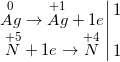
b) 3Ag + 4HNO3, loãng → NO↑ + 3AgNO3 + 2H2O
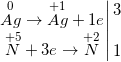
c) 8Al + 30HNO3 → 3N2O↑ + 8Al(NO3)3 + 15H2O
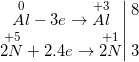
d) 4Zn + 10HNO3 → NH4NO3↑ + 4Zn(NO3)2 + 3H2O
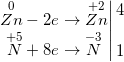
e) 3FeO + 10HNO3 → NO↑ + 3Fe(NO3)3 + 5H2O
f) 3Fe3O4 + 28HNO3 → NO↑ + 9Fe(NO3)3 + 14H2O
* Bài 3 trang 45 SGK Hóa 11: Hãy chỉ ra những tính chất hóa học chung và khác biệt giữa axit nitric và axit sunfuric. Viết các phương trình hóa học để minh họa.
* Lời giải Bài 3 trang 45 SGK Hóa 11:
• Những tính chất giống nhau:
– Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Làm quỳ tím đổi sang màu đỏ
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2↑
– Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2↑ + 2H2O
+ Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2↑ + 2SO2↑ + 2H2O
S + 2HNO3 → H2SO4 + 2NO↑
+ Tác dụng với hợp chất( có tính khử)
3FeO + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
2Fe(OH)2 + 4H2SO4(đặc) → Fe2(SO4)3 + SO2↑ + H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)
• Những tính chất khác nhau:
– Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3 dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chất có tính khử.
– H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe + H2SO4 (loãng) → FeSO4 + H2↑
Cu + H2SO4 (loãng) : không có phản ứng
* Bài 4 trang 45 SGK Hóa 11: a) Trong các phương trình hoá học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
b) Trong phương trình hoá học của phản ứng nhiệt phân thuỷ ngân (II) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
* Lời giải Bài 4 trang 45 SGK Hóa 11:
a) Đáp án: D. 21
– Phương trình của phản ứng nhiệt phân
4Fe(NO3)3 ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/16323725944dmuptmspi_1632373099_1632381883.gif) 2Fe2O3 + 12NO2 + 3O2
2Fe2O3 + 12NO2 + 3O2
b) Đáp án: A. 5
– Phương trình của phản ứng nhiệt phân
Hg(NO3)2 ![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/16323725944dmuptmspi_1632373099_1632381883.gif) Hg + 2NO2 ↑ + O2 ↑
Hg + 2NO2 ↑ + O2 ↑
* Lưu ý: Phản ứng nhiệt phân muối nitrat
– Các muối nitrat của kim loại hoạt động mạnh (K, Na…) bị phân hủy tạo muối nitrit và O2
– Các muối nitrat của kim loại Mg, Zn, Fe, Cu, Pb…. Bị phân hủy tạo oxit kim loại tương ứng, NO2 và O2
– Muối nitrat của Ag, Au, Hg… bị phân hủy tạo thành kim loại tương ứng, NO2 và O2
* Bài 5 trang 45 sgk hoá 11: Viết phương trình hóa học của phản ứng thực hiện dãy chuyển hóa sau:
NO2 → HNO3 → Cu(NO3)2 → Cu(OH)2 → Cu(NO3)2 → CuO → Cu → CuCl2
* Lời giải bài 5 trang 45 sgk hoá 11:
– Ta có các PTPƯ sau:
(1). 4NO2 + O2 + 2H2O → 4HNO3
(2). 8HNO3 + 3Cu → 3Cu(NO3)2 + 2NO↑ + 4H2O
Hoặc CuO + 2HNO3 → Cu(NO3)2 + H2O
(3). Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
(4). Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
(5). 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
(6) CuO + H2 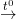 Cu + H2O
Cu + H2O
(7) Cu + Cl2 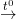 CuCl2
CuCl2
* Bài tập 6 trang 45 sgk hoá 11: Khi hoà tan 30,0g hỗn hợp đồng và đồng (II) oxit trong 1,5 lít dung dịch axit nitric 1,00M (loãng) thấy thoát ra 6,72 lit nitơ monooxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích các dung dịch không thay đổi.
* Lời giải bài tập 6 trang 45 sgk hoá 11:
– Theo bài ra, ta có: nHNO3 = 1,5. 1,00 = 1,5 (mol)
nNO = 6,72/22,4 = 0,3 (mol)
– PTPƯ: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
– Theo PTPƯ (1) ta có: nCu = (3/2).nNO = (3/2). 0,3 = 0,45 mol
– Gọi số mol CuO tham gia phản ứng là x (nCuO = x mol)
Ta có: mhỗn hợp = mCu + mCuO = 0,45. 64 + 80x = 30,00
⇒ x = 0,015 ⇒ nCuO = 0,015 mol ⇒ mCuO = 0,015. 80 = 1,2 g
(Hoặc mCuO = 30 – 0,45. 64 = 1,2g)
%CuO= (1,2/30). 100% = 4%
– Theo PTPƯ (1) ta có: nCu(NO3)2 = nCu = 0,45 (mol)
– Theo PTPƯ (2) ta có: nCu(NO3)2 = nCuO = 0,015 (mol)
Vậy tổng số mol: nCu(NO3)2 = 0,45 + 0,015 = 0,465(mol)
CM Cu(NO3)2 = 0,465/1,5 = 0,31(M)
– Theo PTPƯ (1) ta có: nHNO3 = 4. nNO = 4. 0,3 = 1,2 mol
– Theo PTPƯ (2) ta có: nHNO3 = 2. nCuO= 2. 0,015 = 0,03 mol
nHNO3 (dư)= 1,5 – 1,2 – 0,03 = 0,27(mol)
CM HNO3 = 0,27/1,5 = 0,18(M)
* Bài tập 7 trang 45 sgk hoá 11: Để điều chế được 5,000 tấn axit nitric nồng độ 60,0% cần dùng bao nhiêu tấn amoniac? Biết rằng sự hao hụt amoniac trong quá trình sản xuất là 3,8%.
* Lời giải bài tập 7 trang 45 sgk hoá 11:
– Theo bài ra, khối lượng HNO3 nguyên chất là: 5.(60/100) = 5 (tấn).
Sơ đồ phản ứng điều chế HNO3 từ NH3
NH3 → NO → NO2 → HNO3
1(mol) 1(mol)
17(tấn) 63(tấn)
x(tấn) 3(tấn)
Theo sơ đồ điều chế ta thấy nHNO3 = nNH3
⇒ mNH3 = (3.17)/63 =17/21 = 0,809524 (tấn).
– Khối lượng NH3 hao hụt là 3,8% nghĩa là hiệu suất đạt 100 – 3,8 = 96,2%
⇒ Vậy khối lượng amoniac cầ dùng là: 0,809534/(96,2%) = 0,809534.(100/96,2) = 0,8415 (tấn).
Tóm lại với bài viết về tính chất hóa học của muối nitrat các em cần ghi nhớ được các tính chất hóa học của muối này để vận dụng trong việc giải các bài tập về muối nitrat.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





