Hóa 8 bài 23: Bài tập về Mol, tính khối lượng Mol và Tỉ khối của chất khí. Ở các bài trước các em đã được học về Mol, công thức và cách tính khối lượng mol, thể tích Mol và tỉ khối của chất khí.
Trong bài này chúng ta sẽ cùng ôn lại các nội dung kiến thức về khối lượng mol, thể tích mol cùng công thức cách tính tỉ khối của chất khí, đặc biệt là vận dụng các công thức này để làm bài tập.
This post: Hóa 8 bài 23: Bài tập về Mol, tính khối lượng Mol và Tỉ khối của chất khí
I. Tóm tắt lý thuyết
1. Mol
– Định nghĩa: Mol là những chất có chứa N (6 . 1023) nguyên tử hoặc phân tử chất đó
– Số 6,02.1023 được gọi là số Avogađro và được kí hiệu là N
(Lưu ý: số Avogađro thường lấy tròn số là 6.1023)
• Các cụm từ sau có ý nghĩa như thế nào?
– 1 mol nguyên tử Cu
– 1,5 mol nguyên tử H
– 2 mol phân tử H2
– 0,15 mol phân tử H2O
• Có nghĩa là:
– 1 N nguyên tử Cu hay 6.10 nguyên tử Cu
– 1,5 N nguyên tử H hay 1,5.6.1023 =9.1023 nguyên tử H
– 2 N phân tử H2 hay 2.6.1023 = 12.1023 phân tử H2
– 0,15 N phân tử H O hay 0,15.6.1023 = 0,9.1023 phân tử H2O
2. Khối lượng mol
– Khối lượng mol (kí hiệu là M) của một chất là khối lượng của N nguyên tử hoặc phân tử chất đó, tính bằng gam, có số trị bằng nguyên tử khối hoặc phân tử khối.
• Các cụm từ sau có ý nghĩa như thế nào?
– Khối lượng mol của nước (H2O) là 18 g/mol
– Khối lượng mol nguyên tử hidro (H) là 1g/mol
– Khối lượng mol phân tử hidro (H2) là 2 g/mol
• Có nghĩa là:
– Khối lượng N phân tử H2O hay 6.1023 phân tử H2O là 18 g. Kí hiệu là 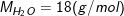
– Khối lượng N nguyên tử hiđro (H) là 1 g. Kí hiệu là 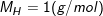
– Khối lượng N phân tử hiđro (H2) là 2 g. Kí hiệu là 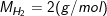
3. Thể tích mol khí
– Thể tích mol của chất là thể tích chiếm bởi N phân tử chất đó. Ở điều kiện chuẩn, thể tích mol các chất khí đều bằng 22,4 lít.
• Hãy cho biết?
– Thể tích mol của các chất khí ở cùng điều kiện nhiệt độ vào áp suất
– Thể tích mol của các chất khí ở cùng điều kiện tiêu chuẩn (00C và 1 atm).
– Khối lượng mol và thể tích mol của những chất khí khác nhau
• Trả lời:
– Ở cùng điều kiện nhiệt độ và áp suất, 1 mol của bất kỳ chất khí nào cũng chiếm những thể tích bằng nhau.
– Nếu nhiệt độ là 00C và áp suất là 1 atm thì những thể tích khí đó bằng 22,4 lít.
– Những chất khí khác nhau (H2, O2, CO2,…) tuy có khối lượng mol khác nhau (MH2 = 2 g/mol; MO2 = 32 g/mol; MCO2,…) nhưng chúng có thể tích bằng nhau (ở cùng nhiệt độ và áp suất). Nếu ở ĐKTC thì:
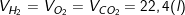
4. Tỉ khối của chất khí
– dA/B là tỉ khối của khí A đối với khí B
– dA/kk là tỉ khối của khí A đối với không khí
• Các câu sau có ý nghĩa như thế nào?
– Tỉ khối của khí A đối với khí B (dA/B) bằng 1,5
– Tỉ khối của khí CO2 đối với không khí (dCO2/kk) bằng 1,52
• Có nghĩa là:
– Khí A nặng hơn khí B 1,5 lần
– Khí CO2 nặng hơn không khí 1,52 lần
II. Bài tập vận dụng công thức tính khối lượng mol, thể tích mol và tỉ khối chất khí.
* Bài 1 trang 79 SGK Hóa 8: Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2g lưu huỳnh kết hợp với 3g oxi.
° Lời giải bài 1 trang 79 SGK Hóa 8:
– Số mol của nguyên tử lưu huỳnh là: 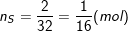
– Số mol của nguyên tử oxi là: 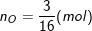
– Ta có: 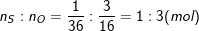
– Như vậy, trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
⇒ Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.
* Bài 2 trang 79 SGK Hóa 8: Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là 36,8% Fe; 21,0% S; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol.
° Lời giải bài 2 trang 79 SGK Hóa 8:
– Theo bài ra, ta có:
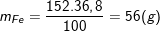
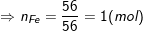
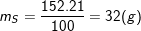
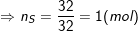
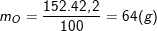
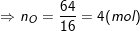
– Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.
* Bài 3 trang 79 SGK Hóa 8: Một hợp chất có công thức hóa học là K2CO3. Em hãy cho biết:
a) Khối lượng mol của chất đã cho.
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố có trong hợp chất.
° Lời giải bài 3 trang 79 SGK Hóa 8:
– Theo bài ra, ta có:
a) Khối lượng mol của K2CO3 là:
MK2CO3 = 39.2 + 12 + 16.3 = 138 (g)
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố
%K = 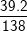 .100% = 56,5%
.100% = 56,5%
%C = 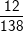 .100% = 8,7%
.100% = 8,7%
%O = 100% – (56,5% + 8,7%) = 34,8%
* Bài 4 trang 79 SGK Hóa 8: Có phương trình hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
a) Tính khối lượng canxi clorua thu được khi cho 10g canxi cacbonat tác dụng với axit clohiđric dư.
b) Tính thể tích khí cacbonic thu được trong phòng thí nghiệm, nếu có 5g canxi cacbonat tác dụng hết với axit. Biết 1 mol khí ở điều kiện phòng có thể tích là 24 lít.
° Lời giải bài 4 trang 79 SGK Hóa 8:
a) Số mol canxi cacbonat tham gia phản ứng là:
nCaCO3= 10/100 = 0,1 mol.
– Phương trình hóa học của phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
– Theo phương trình hóa học, ta có:
nCaCl2 = nCaCO3 = 0,1 (mol).
– Khối lượng của canxi clorua tham gia phản ứng:
mCaCl2 = 0,1 . (40 + 71) = 11,1 g.
b) Số mol canxi cacbonat tham gia phản ứng:
nCaCO3= 5/100 = 0,05 mol.
– Theo phương trình hóa học, ta có: nCO2= nCaCO3 = 0,05 mol.
– Thể tích khí CO2 ở điều kiện phòng là: VCO2 = 24 . 0,05 = 1,2 lít.
* Bài 5 trang 79 SGK Hóa 8: Khí metan CH4 có trong khí tự nhiên hoặc trong khí bioga. Khí metan cháy trong không khí sinh ra khí cacbon đioxit và nước:
CH4 + 2O2 → CO2 + 2H2O.
a) Tính thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 khí metan. Các thể tích khí đo cùng điều kiện nhiệt độ (to) và áp suất (p).
b) Tính thể tích khí CO2 (đktc) thu được sau khi đốt cháy hoàn toàn 0,15 mol khí metan.
c) Khí metan nặng hay nhẹ hơn không khí bằng bao nhiêu lần?
° Lời giải bài 5 trang 79 SGK Hóa 8:
a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2.
– Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2.2 = 4 (lít).
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit.
– Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15.22,4 = 3,36 (lít_.
c) Tỉ khối của khí metan và không khí là:
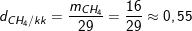
– Như vậy, khí metan nhẹ hơn không khí 0,55.
Hy vọng với phần Bài tập về Mol, tính khối lượng Mol và Tỉ khối của chất khí ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục