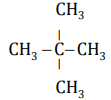Hóa 11 bài 40: Tính chất hóa học và công thức cấu tạo của Ancol. Ancol là những hợp chất hữu cơ trong phân tử có chứa nhóm -OH liên kết với nguyên tử C no của gốc hiđrocacbon và ancol có nhiều ứng dụng trong lĩnh vực công nghiệp thực phẩm, y tế…
Vậy ancol có tính chất hóa học, tính chất vật lý và công thức cấu tạo như thế nào, được điều chế và ứng dụng ra sao chúng ta cùng tìm hiểu qua bài viết dưới đây.
This post: Hóa 11 bài 40: Tính chất hóa học và công thức cấu tạo của Ancol
I. Ancol – định nghĩa, phân loại và danh pháp
1. Định nghĩa ancol là gì?
– Ancol là những hợp chất hữu cơ trong phân tử có chứa nhóm -OH liên kết với nguyên tử C no của gốc hiđrocacbon.
2. Bậc của Ancol, phân loại ancol
– Dựa vào số nhóm -OH trong phân tử các ancol được phân làm ancol đơn chức và ancol đa chức.
– Bậc của ancol được tính bằng bậc của nguyên tử cacbon liên kết với nhóm -OH.
– Ancol no đơn chức mạch hở: Phân tử có 1 nhóm -OH liên kết với gốc Ankyl: CnH2n+1-OH
Ví dụ: CH3-OH, C3H7-OH,…
– Ancol không no, đơn chức, mạch hở: Phân tử có 1 nhóm -OH liên kết với nguyên tử cacbon no của gốc hidrocacbon không no.
Ví dụ: CH2=CH-CH2-OH, CH3-CH=CH-CH2-OH, …
– Ancol thơm, đơn chức: Phân tử có nhóm -OH liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen
Ví dụ: C6H5-CH2-OH (ancol benzyic)
– Ancol vòng no, đơn chức: Phân tử có nhóm -OH liên kết với nguyên tử cacbon no thuộc nhóm hidrocacbon vòng no:
Ví dụ: C6H11OH xiclohexanol
– Ancol đa chức: Phân tử có 2 hay nhiều nhóm -OH ancol
Ví dụ: HO-CH2-CH2-OH etylen glicol ; HO-CH2-CH2OH- CH2-OH glixerol ;
3. Danh pháp
a) Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + số chỉ vị trí nhóm OH + ol
b) Tên thường
Tên thường = ancol (rượu) + Tên gốc hiđrocacbon + ic
Chú ý: Một số ancol có tên riêng cần nhớ:
CH2OH-CH2OH : Etilenglicol
CH2OH-CHOH-CH2OH : Glixerin (Glixerol)
CH3-CH(CH3)-CH2-CH2OH : Ancol isoamylic
II. Tính chất vật lý của Ancol
1. Trạng thái của ancol
– Từ C1 đến C12 là chất lỏng, từ C13 trở lên là chất rắn.
2. Nhiệt độ sôi của ancol
– So với các chất có M tương đương thì nhiệt độ sôi của: Muối > Axit > Ancol > Anđehit > Hiđrocacbon, ete và este…
– Giải thích: nhiệt độ sôi của một chất thường phụ thuộc vào các yếu tố:
+ M: M càng lớn thì nhiệt độ sôi càng cao.
+ Độ phân cực của liên kết: liên kết ion > liên kết cộng hóa trị có cực > liên kết cộng hóa trị không cực.
+ Số liên kết hiđro: càng nhiều liên kết H thì nhiệt độ sôi càng cao.
+ Độ bền của liên kết hiđro: liên kết H càng bền thì nhiệt độ sôi càng cao.
3. Độ tan của ancol
– Ancol có 1, 2, 3 nguyên tử C trong phân tử tan vô hạn trong nước.
– Ancol có càng nhiều C, độ tan trong nước càng giảm vì tính kị nước của gốc hiđrocacbon tăng.
III. Tính chất hóa học của Ancol
1. Ancol phản ứng với kim loại kiềm (Ancol + Na).
– phản ứng của Ancol + Na
R(OH)z + zNa → R(ONa)z + z/2H2↑
– Ancol hầu như không phản ứng được với NaOH mà ngược lại natri ancolat bị phân hủy hoàn toàn
R(ONa)z + zH2O → R(OH)z + zNaOH
Chú ý: – Trong phản ứng của ancol với Na:
mbình Na tăng = mAncol – mH2 = nAncol.(MR + 16z).
mbình Ancol tăng = mNa – mH2 = nAncol.22z.
– Nếu cho dung dịch ancol phản ứng với Na thì ngoài phản ứng của ancol còn có phản ứng của H2O với Na.
– Số nhóm chức Ancol = 2.nH2/nAncol.
2. Ancol phản ứng với axit
a) Ancol phản ứng với axit vô cơ HX (Ancol + H2SO4, Ancol + HCl)
CnH2n+2-2k-z(OH)z + (z + k)HX → CnH2n + 2 – zXz + k
→ số nguyên tử X bằng tổng số nhóm OH và số liên kết pi.
b) Ancol phản ứng với axit hữu cơ (phản ứng este hóa)
ROH + R’COOH ↔ R’COOR + H2O
yR(OH)x + xR’(COOH)y ↔ R’x(COO)xyRy + xyH2O
* Chú ý:
– Phản ứng được thực hiện trong môi trường axit và đun nóng.
– Phản ứng có tính thuận nghịch nên chú ý đến chuyển dịch cân bằng.
3. Phản ứng tách nước (đề hiđrat hóa)
a) Tách nước từ 1 phân tử ancol tạo anken của ancol no, đơn chức, mạch hở.
CnH2n+1OH → CnH2n + H2O (H2SO4 đặc, >1700C)
– Điều kiện của ancol tham gia phản ứng: ancol có Hα.
* Chú ý:
– Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó không có Hα (là CH3OH hoặc ancol mà nguyên tử C liên kết với OH chỉ liên kết với C bậc 3 khác).
– Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken thì đó là ancol bậc cao (bậc II, bậc III) và mạch C không đối xứng qua C liên kết với OH.
– Nhiều ancol tách nước tạo ra một anken thì xảy ra các khả năng sau:
+ Có ancol không tách nước.
+ Các ancol là đồng phân của nhau.
– Sản phẩm chính trong quá trình tách nước theo quy tắc Zaixep.
– Khi giải bài tập có liên quan đến phản ứng tách nước cần nhớ:
mAncol = manken + mH2O + mAncol dư
nancol phản ứng = nanken = nnước
– Các phản ứng tách nước đặc biệt:
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
b) Tách nước từ 2 phân tử ancol tạo ete
ROH + ROH → ROR + H2O (H2SO4 đặc; 1400C)
ROH + R’OH → ROR’ + H2O (H2SO4 đặc; 1400C)
Chú ý:
– Từ n ancol khác nhau khi tách nước ta thu được n.(n + 1)/2 ete trong đó có n ete đối xứng.
– Nếu tách nước thu được các ete có số mol bằng nhau thì các ancol tham gia phản ứng cũng có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và nAncol = mete + nH2O + mAncol dư.
4. Phản ứng oxi hóa (Ancol + O2)
a) Oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
Chú ý:
– Phản ứng đốt cháy của ancol có đặc điểm tương tự phản ứng đốt cháy hiđrocacbon tương ứng.
+ Nếu đốt cháy ancol cho nH2O > nCO2 → ancol đem đốt cháy là ancol no và nAncol = nH2O – nCO2.
+ Nếu đốt cháy ancol cho nH2O > 1,5.nCO2 → ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin).
– Khi đốt cháy 1 hợp chất hữu cơ X thấy nH2O > nCO2 → chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở (cùng có công thức CnH2n+2Ox).
b) Oxi hóa không hoàn toàn (Ancol + CuO hoặc O2 có xúc tác là Cu)
– Ancol bậc I + CuO tạo anđehit:
RCH2OH + CuO → RCHO + Cu + H2O
– Ancol bậc II + CuO tạo xeton:
RCHOHR’ + CuO → RCOR’ + Cu + H2O
– Ancol bậc III không bị oxi hóa bằng CuO.
* Chú ý: mchất rắn giảm = mCuO phản ứng – mCu tạo thành = 16.nAncol đơn chức.
5. Phản ứng riêng của một số loại ancol
a) Ancol etylic CH3CH2OH:
C2H5OH + O2 → CH3COOH + H2O (men giấm)
2C2H5OH → CH2=CH-CH=CH2 + 2H2O + H2 (Al2O3, ZnO, 4500C)
b) Ancol không no có phản ứng như hidrocacbon tương ứng
– Phản ứng với Hidro, alylic CH2 = CH – CH2OH: Ancol + H2
CH2=CH-CH2OH + H2 → CH3-CH2-CH2OH (Ni, t0)
– Phản ứng với Brom: Ancol + Br2
CH2=CH-CH2OH + Br2 → CH2Br-CHBr-CH2OH
– Phản ứng với dd thuốc tím: Ancol + KMnO4
3CH2=CH-CH2OH + 2KMnO4 + 4H2O → 3C3H5(OH)3 + 2KOH + 2MnO2
c) Ancol đa chức có các nhóm OH liền kề: tạo dung dịch màu xanh lam với Cu(OH)2 ở nhiệt độ thường:
2R(OH)2 + Cu(OH)2 → [R(OH)O]2Cu + 2H2O
d) Một số trường hợp ancol không bền:
+ Ancol có nhóm OH liên kết với C nối đôi chuyển vị thành anđehit hoặc xeton:
CH2=CH-OH → CH3CHO
CH2=COH-CH3 → CH3-CO-CH3
+ Ancol có 2 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo anđehit hoặc xeton:
RCH(OH)2 → RCHO + H2O
HO-CO-OH → H2O + CO2
RC(OH)2R’ → RCOR’ + H2O
+ Ancol có 3 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo thành axit:
RC(OH)3 → RCOOH + H2O
IV. Điều chế Ancol
1. Thủy phân dẫn xuất halogen
CnH2n+2-2k-xXx + xMOH → CnH2n+2-2k-x(OH)x + xMX
2. Cộng nước vào anken tạo ancol no, đơn chức, mạch hở
CnH2n + H2O → CnH2n+1OH (H+)
Phản ứng tuân theo quy tắc cộng Maccopnhicop nên nếu anken đối xứng thì phản ứng chỉ tạo thành 1 ancol.
3. Thủy phân este trong môi trường kiềm
RCOOR’ + NaOH → RCOONa + R’OH
4. Cộng H2 vào anđehit hoặc xeton
RCHO + H2 → RCH2OH (Ni, t0)
RCOR’ + H2 → RCHOHR’ (Ni, t0)
5. Oxi hóa hợp chất có nối đôi bằng dung dịch KMnO4
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2KOH + 2MnO2
6. Phương pháp riêng điều chế CH3OH
CH4 + H2O → CO + 3H2
CO + 2H2 → CH3OH (ZnO, CrO3, 4000C, 200atm)
2CH4 + O2 → 2 CH3OH (Cu, 2000C, 100 atm)
7. Phương pháp điều chế C2H5OH
– Lên men tinh bột:
(C6H10O5)n → C6H12O6 → C2H5OH
– Các phản ứng cụ thể:
(C6H10O5)n + nH2O → nC6H12O6
C6H12O6 → 2C2H5OH + 2CO2 (men rượu)
– Hidrat hóa etilen, xúc tác axit:
C2H4 + H2O → C2H5OH
– Đây là các phương pháp điều chế ancol etylic trong công nghiệp.
V. Cách nhận biết Ancol
– Ancol tạo khí không màu với kim loại kiềm (chú ý mọi dung dịch đều có phản ứng này).
– Ancol làm CuO đun nóng từ màu đen chuyển thành Cu màu đỏ.
– Ancol đa chức có các nhóm OH liền kề hòa tan Cu(OH)2 tạo dung dịch màu xanh.
– Ancol không no có phản ứng làm mất màu dung dịch Brom.
VI. Ứng dụng của ancol
– Metanol chủ yếu được dùng để sản xuất Andehit Fomic nguyên liệu cho công nghiệp chất dẻo.
– Etanol dùng để điều chế một số hợp chất hữu cơ như axit axetic, dietyl ete, etyl axetat,.. do có khả năng hòa tan tốt một số hợp chất hữu cơ nên Etanol được dùng để pha vecni, dược phẩm, nước hoa,…
– Trong đời sống hàng ngày Etanol được dùng để pha chế các loại đồ uống với độ ancol khác nhau.
VII. Bài tập Ancol
Bài 2 trang 186 SGK Hóa 11: Viết phương trình hóa học của phản ứng propan-1-ol với mỗi chất sau:
a. Natri kim loại.
b. CuO, đun nóng
c. Axit HBr, có xúc tác
Trong mỗi phản ứng trên ancol giữ vai trò gì: chất khử, chất oxi hoá, axit, bazơ? Giải thích.
* Lời giải bài 2 trang 186 SGK Hóa 11:
a) 2CH3-CH2-CH2OH + 2Na → 2CH3-CH2-CH2ONa + H2↑
Ancol đóng vai trò chất oxi hóa
b) CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O
Ancol đóng vai trò chất khử
c) CH3-CH2-CH2OH + HBr → CH3-CH2-CH2Br + H2O
Ancol đóng vai trò bazơ
Bài 3 trang 186 SGK Hóa 11: Trình bày phương pháp hoá học để phân biệt các chất lỏng đựng trong các lọ không dán nhãn: etanol, glixerol, nước và benzen.
* Lời giải bài 3 trang 186 SGK Hóa 11:
Hy vọng với bài viết về tính chất hóa học, tính chất vật lý của ancol và bài tập vận dụng ở trên hữu ích với các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục