Sau khi làm quen hợp chất hữu cơ là các hợp chất của cacbon, thì cấu tạo phân tử của hợp chất hữu cơ là nội dung tiếp theo mà các em cần nắm vững.
Công thức cấu tạo của hợp chất hữu cơ cho biết điều gì? Trong phân tử của hợp chất hữu cơ các nguyên tử của chúng được liên kết với nhau như thế nào, hóa trị là bao nhiêu? chúng ta cùng tìm hiểu qua bài viết dưới đây.
This post: Cấu tạo phân tử của hợp chất hữu cơ, bài tập áp dụng – hóa 9 bài 35
I. Cấu tạo phân tử của hợp chất hữu cơ
1. Hóa trị của các nguyên tử trong hợp chất hữu cơ
– Trong các hợp chất hữu cơ cacbon luôn có hóa trị IV, hiđro hóa trị I, oxi hóa trị II.
– Hóa trị được biểu diễn bằng nét gạch nối như sau:
Cacbon: 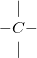 oxi:
oxi: 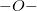 Hiđro:
Hiđro: 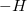
– Hóa trị của các nguyên tử trong hợp chất hữu cơ được biểu diễn bằng số liên kết của nguyên tử đó với các nguyên tử khác.
2. Liên kết giữa các nguyên tử trong hợp chất hữu cơ, mạch cacbon
– Trong phân tử hợp chất hữu cơ, các nguyên tử sẽ liên kết với nhau để tạo thành liên kết. Có thể là liên kết giữa 2 nguyên tử C và H, C và O hoặc C và C,…
– Số liên kết tạo thành đối với một nguyên tử luôn bằng với hóa trị của nó.
Ví dụ 1: Xét cấu tạo của phân tử khí metan CH4 như sau:
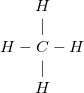
Ví dụ 2: Xét cấu tạo của phân tử methanol CH3OH như sau:
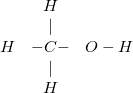
Ví dụ 3: Xét cấu tạo phân tử khí etan CH3 -CH3 như sau:
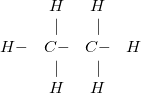
– Những nguyên tử cacbon trong phân tử hợp chất hữu cơ có thể liên kết trực tiếp với nhau tạo thành mạch cacbon.
– Có 3 loại mạch cacbon, đó là: mạch thẳng, mạch nhánh và mạch vòng.
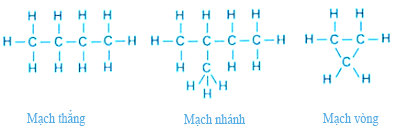
II. Công thức cấu tạo của hợp chất hữu cơ
– Công thức biểu diễn đầy đủ liên kết giữa các nguyên tử trong phân tử gọi là công thức cấu tạo, ví dụ:
Metan: 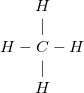 viết gọn: CH4
viết gọn: CH4
Rượu Etylic: 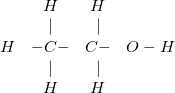 viết gọn: CH3-CH2-OH
viết gọn: CH3-CH2-OH
– Như vậy, công thức cấu tạo cho biết thành phần của phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.
– Nếu thay đổi trật tự liên kết giữa các nguyên tử trong phân tử sẽ tạo ra chất mới như ví dụ, cùng có công thức phân tử là C2H6O nhưng có 2 loại chất khác nhau là rượu etylic (chất lỏng) và đimetyl ete (chất khí).
+ Công thức cấu tạo rượu Etylic: 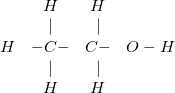
+ Công thức cấu tạo của đimetyl ete: 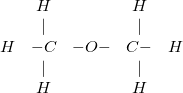
III. Bài tập cấu tạo phân tử hợp chất hữu cơ
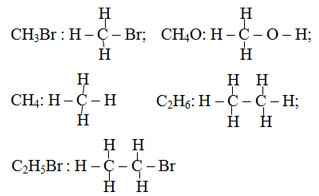
Bài 2 trang 112 sgk hoá 9: Hãy viết công thức cấu tạo của các chất có công có công thức phân tử sau CH3Br, CH4O, CH4, C2H6, C2H5Br. Biết rằng brom có hóa trị I.
Lời giải bài 2 trang 112 sgk hoá 9:
Bài 4 trang 112 sgk hoá 9: Những công thức cấu tạo nào sau đây biểu diễn cùng một chất?
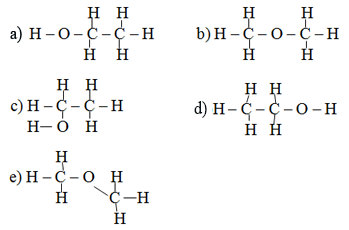
Lời giải bài 4 trang 112 sgk hoá 9:
– Bài này các em cần để ý liên kết mạch cacbon (và nhóm chức), các em thấy các công thức a, c, d thì 2 nguyên tử cacbon liên kết trực tiếp, còn b, e 2 nguyên tử cacbon liên kết qua O; Như vậy:
+ Các công thức a), c), d) đều là công thức phân tử của rượu etylic C2H5OH (CH3CH2OH).
+ Các công thức b), e) là công thức phân tử của ete: CH3OCH3.
Bài 5 trang 112 sgk hóa 9: Phân tử hợp chất hữu cơ A, có hai nguyên tố. Khi đốt cháy 3g chất A thu được 5,4g H2O. Hãy xác định công thức phân tử của A, biết khối lượng mol của A là 30g.
Lời giải bài 5 trang 112 sgk hóa 9:
– Gọi CT tổng quát của hợp chất hữu cơ A, có 2 nguyên tố là CxHy
– Phương trình hóa học
4CxHy + (4x + y)O2 → 4xCO2 + 2yH2O (1)
4 mol (4x + y) mol 4x mol 2y mol
0,1 mol 0,3 mol
nA = 3/30 = 0,1 (mol); nH2O = 5,4/18 = 0,3 (mol)
Từ PTPƯ (1) ta có tỉ lệ: 4/0,1 = 2y/0,3 ⇒ y = 6.
Mặt khác: MA = 12x + y = 30 (2)
Thay y = 6 vào (2) ta có x = 2. Vậy công thức của A là C2H6
Hy vọng với bài viết hệ thống lại kiến thức về cấu tạo phân tử của hợp chất hữu với các bài tập áp dụng ở trên hữu ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được hỗ trợ, nếu thấy hay các em hãy chia sẻ, chúc các em học tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục