Hướng dẫn cách tính hóa trị của các nguyên tố và ví dụ
Khi bắt đầu làm quen với môn Hóa học, chúng ta sẽ tìm hiểu về khái niệm hóa trị. Đây là nền tảng cơ bản của môn Hóa học vì nó biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác. Đồng thời chúng ta sẽ tìm hiểu xem liệu nguyên tố đó có hóa trị bao nhiêu và cách tính hóa trị của nó như thế nào. Đầu tiên, chúng ta cùng tìm hiểu về khái niệm hóa trị là gì?

This post: Hướng dẫn cách tính hóa trị của các nguyên tố và ví dụ
Nội dung chính
Hóa trị là gì?
– Hóa trị là của các nguyên tố xác định bằng số liên kết mà một nguyên tử của nguyên tố đó liên kết nên trong phân tử.
– Hóa trị của nguyên tố ở hợp chất ion được gọi là điện hóa trị và nó có giá trị bằng với điện tích ion tạo thành từ nguyên tố ấy.
– Hóa trị của nguyên tố ở hợp chất cộng hóa trị gọi là cộng hóa trị, và có giá trị bằng với số liên kết cộng hóa trị do nguyên tử của nguyên tố đó tạo được với nguyên tử của nguyên tố khác trong hợp chất.
Quy tắc hóa trị.
Ta có quy tắc hóa trị như sau: Tích giữa chỉ số và hóa trị của nguyên tố này bằng tích giữa chỉ số và hóa trị của nguyên tố kia.
Theo quy tắc hóa trị thì: x.a = y.b
Trong đó:
– x, y là các hóa trị của nguyên tố
– a, b là các chỉ số
– Nếu biết x, y và a (hoặc b) thì tính được b (hoặc a)
– Nếu biết a, b thì tìm được x, y để lập công thức hóa học
Chuyển thành tỉ lệ:
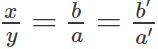
Lấy x = b (hoặc b’) và y = a (hoặc a’). Nếu a’, b’ là những số nguyên đơn giản hơn so với a, b.
Cách tính hóa trị một nguyên tố.
Hóa trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của O là hai đơn vị.
Phương pháp:
– Gọi a là hóa trị của nguyên tố cần tìm.
– Áp dụng quy tắc về hóa trị để lập đẳng thức.
– Giải đẳng thức trên để tìm a
Chú ý: – H và O đương nhiên đã biết hóa trị: H(I), O(II).
– Kết quả phải ghi số La Mã.
Ví dụ minh họa
Ví dụ 1: Xác định hóa trị của mỗi nguyên tố trong các trường hợp sau đây:
a) KH, H2S, CH4
b) FeO, Ag2O, NO2
Lời giải:
a) KH: Có H có hóa trị I, theo quy tắc hóa trị ta có: 1 x 1 = 1 x b => K hóa trị I.
H2S: có H có hóa trị I, theo quy tắc hóa trị, ta có: 2 x 1 = 1 x b => S hóa trị II.
CH4: có H có hóa trị I, theo quy tắc hóa trị, ta có: 1 x a = 4 x 1 => C hóa trị IV.
b) FeO: có O hóa trị II, theo quy tắc hóa trị, ta có: 1 x a = 2 x 1 => Fe hóa trị II
Ag2O: có O hóa trị II, theo quy tắc hóa trị, ta có 2 x a = 1 x 2 => Ag hóa trị I.
NO2: có O hóa trị II, theo quy tắc hóa trị, ta có: 1 x a = 2 x 2 => N hóa trị IV
Ví dụ 2: Biết N (IV), hãy chọn công thức hóa học phù hợp với quy tắc hóa trị trong số các công thức sau: NO, N2O3, N2O, NO2.
Hướng dẫn:
Ta có: N hóa trị IV, O hóa trị II.
Theo quy tắc hóa trị, ta có: x * 4 = y * 2
Chuyển thành tỉ lệ: x / y = 2/4 = 1/2
Vậy: công thức hóa học phù hợp nhất là NO2.
✅ Ghi nhớ: Các công thức Hóa Học lớp 8
Bài tập áp dụng về cách tính hóa trị
Bài 1: Tính hóa trị của các nguyên tố có trong hợp chất sau
a) Na2O g) P2O5
b) SO2 h) Al2O3
c) SO3 i) Cu2O
d) N2O5 j) Fe2O3
e) H2S k) SiO2
f) PH3 l) FeO
Bài 2: Xác định hóa trị các nguyên tố trong các hợp chất sau, biết hóa trị của O là II.
1.CaO 2.SO3 3.Fe2O3 4. CuO 5.Cr2O3 6.MnO2 7.Cu2O
8.HgO 9.NO2 10.FeO 11.PbO2 12.MgO 13.NO 14.ZnO
15.PbO 16.BaO 17.Al2O3 18.N2O 19.CO 20.K2O 21.Li2O
22.N2O3 23.Hg2O 24.P2O3 25.Mn2O7 26.SnO2 27.Cl2O7 28.SiO2
Đáp án
Bài 1:
a) Na (I) b) S (IV) c) S (VI) d) N (V)
e) S (II) f) P (III) g) P (V) h) Al (III)
i) Cu (I) j) Fe (III) k) Si (IV) l) Fe (II)
Bài 2:
1. Ca (II) 2. S (VI) 3. Fe (III) 4. Cu (II) 5. Cr (III)
6. Mn (IV) 7. Cu (I) 8. Hg (II) 9. N(IV) 10. Fe (II)
11. Pb (IV) 12. Mg (II) 13. N (II) 14. Zn (II) 15. Pb(II)
16. Ba (II) 17. Al (III) 18. N (I) 19. C (II) 20. K (I)
21. Li (I) 22. N (III) 23. Hg (I) 24. P (III) 25.Mn (VII)
26.Sn (IV) 27. Cl (VII) 28. Si (IV)
Bài 3: Lập công thức hóa học của hợp chất tạo bởi Nito (IV) và Oxi (II)
Lời giải
Giả sử công thức hợp chất cần lập là: NxOy.
Theo qui tắc hóa trị ta có: a * x = b * y => x * IV = y * II
Chuyển thành tỉ lệ: x / y = 1/2
Vậy công thức cần lập là: NO2
Bài 4: Lập công thức hóa học của hợp chất bao gồm:
Nhôm (III) và nhóm SO4 (II)
Kali (I) và nhóm (CO3) (II)
Lời giải
a) Giả sử công thức hợp chất cần lập là: Kx(CO3)y
Theo qui tắc hóa trị ta có: a * x = b * y => x * I = y * II
Chuyển thành tỉ lệ: x / y= 2/1
Vậy công thức cần lập là: K2CO3
b) Giả sử công thức hợp chất cần lập là: Alx(SO4)y
Theo qui tắc hóa trị ta có: a * x = b * y => x * III = y * II
Chuyển thành tỉ lệ: x / y= 2/3
Vậy công thức cần lập là: Al2(SO4)3
Thực hành:
- Bài tập cân bằng phương trình hóa học.
Dựa vào bài học bên trên chắc hẳn chúng ta đã biết cách tính hóa trị của một nguyên tố và một một số bài tập áp dụng. Ngoài ra, các em có thể học hóa trị của các nguyên tố thông qua bài ca hóa trị để nhớ hóa trị của nguyên tố nhanh hơn khi làm bài tập và có thể kiểm tra tính chính xác của bài mình vừa làm. Chúc các em học tốt!
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục