Hóa 8 bài 17: Bài tập luyện tập phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học. Ở các bài học trước các em đã tìm hiểu khái niệm về hiện tượng hóa học phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học.
Nội dung bài này chúng ta sẽ củng cố kiến thức về hiện tượng hóa học, phản ứng hóa học, định luật bảo toàn khối lượng và cách lập phương trình hóa học, đồng thời vận dụng vào một số bài tập cơ bản.
I. Kiến thức cần nhớ về phản ứng hóa học, định luật bảo toàn khối lượng, phương trình hóa học.
1. Sự biến đổi từ chất này thành chất khác được gọi là hiện tượng hóa học. Quá trình biến đổi chất như thế được gọi là phản ứng hóa học
Trong phản ứng hóa học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử làm cho phân tử biến đổi, kết quả là chất biến đổi. Còn số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng.
Dựa vào định luật bảo toàn khối lượng tính được khối lượng của một chất khi biết khối lượng của các chất khác nhau trong phản ứng.
2. Phương trình hóa học gồm những công thức hóa học của các chất trong phản ứng với hệ số thích hợp sao cho số nguyên tử mỗi nguyên tố ở hai bên đều bằng nhau.
Để lập phương trình hóa học, ta phải cân bằng hệ số nguyên tử của mỗi nguyên tố (và nhóm nguyên tử, nếu có).
* Ví dụ: Lập phương trình hóa học của phản ứng có sơ đồ sau:
Al + HCl → AlCl3 + H2
Trước hết ta làm chẵn số nguyên tử H ở bên trái
Al + 2HCl → AlCl3 + H2
Bắt đầu cân bằng số nguyên tử Cl (bên phải có 3 nguyên tử Cl, bên trái có 2 nguyên tử Cl). Bội số chung nhỏ nhất của 2 và 3 là 6.
Al + 6HCl → 2AlCl3 + H2
Tiếp đến cân bằng số nguyên tử Al và H, ta được:
2Al + 6HCl → 2AlCl3 + 3H2
II. Bài tập vận dụng cân bằng phương trình hóa học, định luật bảo toàn khối lượng
* Bài 1 trang 60 SKG Hóa 8: Hình dưới đây là sơ đồ tương trựng cho phản ứng: Giữa khí N2 và khí H2 tạo ra amoniac NH3.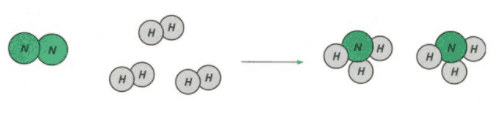
Hãy cho biết:
a) Tên các chất tham gia và sản phẩm?
b) Liên kết giữa các nguyên tử thay đổi như thế nào? Phân tử nào biến đổi, phân tử nào được tạo ra?
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng bằng bao nhiêu có giữ nguyên không?
* Lời giải:
a) Chất tham gia: khí nitơ, khí hiđro.
– Chất tạo thành: khí amoniac.
b) Trước phản ứng hai nguyên tử H liên kết với nhau, hai nguyên tử N cũng tự liên kết với nhau. Sau phản ứng có 3 nguyên tử H liên kết với 1 nguyên tử N.
– Phân tử hiđro và phân tử nitơ biến đổi.
– Phân tử ammoniac được tạo thành.
c) Số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng.
– Số nguyên tử H là 6 và số nguyên tử N là 2.
* Bài 2 trang 60 SKG Hóa 8: Khẳng định sau gồm hai ý: “Trong phản ứng hóa học chỉ phân tử biến đổi còn các nguyên tử giữ nguyên, nên tổng khối lượng các chất phản ứng được bảo toàn”.
Hãy chọn phương án trả lời đúng trong số các phương án cho sau:
A. Ý 1 đúng, ý 2 sai.
B. Ý 1 sai ý 2 đúng.
C. Cả hai ý đều đúng nhưng ý 1 không giải thích ý 2.
D. Cả hai ý đều đúng và ý 1 giải thích ý 2.
E. Cả hai ý đều sai.
* Lời giải:
– Đáp án: D. Cả hai ý đều đúng và ý 1 giải thích ý 2.
* Bài 3 trang 61 SKG Hóa 8: Canxi cacbonat là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau:
Canxi cacbonat → Canxi oxit + Cacbon đioxit.
Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi oxit CaO (vôi sống) và 110kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng của các chất trong phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
* Lời giải:
a) Công thức về khối lượng của các chất trong phản ứng:
– Theo định luật bảo toàn khối lượng: mCaCO3 = mCaO + mCO2
b) Theo bài ra, khối lượng của CaCO3 đã phản ứng:
140 + 110 = 250 kg
Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi là:

* Bài 4 trang 61 SKG Hóa 8: Biết rằng khí etilen C2H4 cháy là xảy ra phản ứng với khí O2 sinh ra khí cacbon đioxit CO2 và nước.
a) Lập phương trình hóa học phản ứng xảy ra?
b) Cho biết tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phân tử cacbon đioxit.
* Lời giải:
a) Phương trình hóa học của phản ứng:
C2H4 + 3O2 → 2CO2 + 2H2O.
b) Số phân tử C2H4 : số phân tử oxi là 1 : 3
Số phân tử C2H4 : số phân tử cacbon đioxit = 1: 2
* Bài 5 trang 61 SKG Hóa 8: Cho sơ đồ của phản ứng như sau:
Al + CuSO4 → Alx(SO4)y + Cu
a) Xác định các chỉ số x và y.
b) Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại số phân tử của cặp hợp chất.
* Lời giải:
a) Xác định các chỉ số x và y: 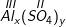
– Ta có: 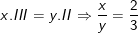
Vậy x = 2, y= 3 ta có công thức: Al2(SO4)3
b) Phương trình hóa học:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Tỉ lệ số nguyên tử của cặp đơn chất kim loại là số nguyên tử Al : số nguyên tử Cu = 2 : 3;
Hy vọng với nội dung Bài tập luyện tập hiện tượng hóa học, phản ứng hóa học, định luật bảo toàn năng khối lượng và cách lập phương trình hóa học ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tốt.
Xem thêm Hóa 8 bài 17
Hóa 8 bài 17: Bài tập luyện tập phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học. Ở các bài học trước các em đã tìm hiểu khái niệm về hiện tượng hóa học phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học. Nội dung bài này chúng ta sẽ củng cố kiến thức về hiện tượng hóa học, phản ứng hóa học, định luật bảo toàn khối lượng và cách lập phương trình hóa học, đồng thời vận dụng vào một số bài tập cơ bản. I. Kiến thức cần nhớ về phản ứng hóa học, định luật bảo toàn khối lượng, phương trình hóa học. 1. Sự biến đổi từ chất này thành chất khác được gọi là hiện tượng hóa học. Quá trình biến đổi chất như thế được gọi là phản ứng hóa học Trong phản ứng hóa học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử làm cho phân tử biến đổi, kết quả là chất biến đổi. Còn số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng. Dựa vào định luật bảo toàn khối lượng tính được khối lượng của một chất khi biết khối lượng của các chất khác nhau trong phản ứng. 2. Phương trình hóa học gồm những công thức hóa học của các chất trong phản ứng với hệ số thích hợp sao cho số nguyên tử mỗi nguyên tố ở hai bên đều bằng nhau. Để lập phương trình hóa học, ta phải cân bằng hệ số nguyên tử của mỗi nguyên tố (và nhóm nguyên tử, nếu có). * Ví dụ: Lập phương trình hóa học của phản ứng có sơ đồ sau: Al + HCl → AlCl3 + H2 Trước hết ta làm chẵn số nguyên tử H ở bên trái Al + 2HCl → AlCl3 + H2 Bắt đầu cân bằng số nguyên tử Cl (bên phải có 3 nguyên tử Cl, bên trái có 2 nguyên tử Cl). Bội số chung nhỏ nhất của 2 và 3 là 6. Al + 6HCl → 2AlCl3 + H2 Tiếp đến cân bằng số nguyên tử Al và H, ta được: 2Al + 6HCl → 2AlCl3 + 3H2 II. Bài tập vận dụng cân bằng phương trình hóa học, định luật bảo toàn khối lượng * Bài 1 trang 60 SKG Hóa 8: Hình dưới đây là sơ đồ tương trựng cho phản ứng: Giữa khí N2 và khí H2 tạo ra amoniac NH3. Hãy cho biết: a) Tên các chất tham gia và sản phẩm? b) Liên kết giữa các nguyên tử thay đổi như thế nào? Phân tử nào biến đổi, phân tử nào được tạo ra? c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng bằng bao nhiêu có giữ nguyên không? * Lời giải: a) Chất tham gia: khí nitơ, khí hiđro. – Chất tạo thành: khí amoniac. b) Trước phản ứng hai nguyên tử H liên kết với nhau, hai nguyên tử N cũng tự liên kết với nhau. Sau phản ứng có 3 nguyên tử H liên kết với 1 nguyên tử N. – Phân tử hiđro và phân tử nitơ biến đổi. – Phân tử ammoniac được tạo thành. c) Số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng. – Số nguyên tử H là 6 và số nguyên tử N là 2. * Bài 2 trang 60 SKG Hóa 8: Khẳng định sau gồm hai ý: “Trong phản ứng hóa học chỉ phân tử biến đổi còn các nguyên tử giữ nguyên, nên tổng khối lượng các chất phản ứng được bảo toàn”. Hãy chọn phương án trả lời đúng trong số các phương án cho sau: A. Ý 1 đúng, ý 2 sai. B. Ý 1 sai ý 2 đúng. C. Cả hai ý đều đúng nhưng ý 1 không giải thích ý 2. D. Cả hai ý đều đúng và ý 1 giải thích ý 2. E. Cả hai ý đều sai. * Lời giải: – Đáp án: D. Cả hai ý đều đúng và ý 1 giải thích ý 2. * Bài 3 trang 61 SKG Hóa 8: Canxi cacbonat là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau: Canxi cacbonat → Canxi oxit + Cacbon đioxit. Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi oxit CaO (vôi sống) và 110kg khí cacbon đioxit CO2. a) Viết công thức về khối lượng của các chất trong phản ứng. b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi. * Lời giải: a) Công thức về khối lượng của các chất trong phản ứng: – Theo định luật bảo toàn khối lượng: mCaCO3 = mCaO + mCO2 b) Theo bài ra, khối lượng của CaCO3 đã phản ứng: 140 + 110 = 250 kg Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi là: * Bài 4 trang 61 SKG Hóa 8: Biết rằng khí etilen C2H4 cháy là xảy ra phản ứng với khí O2 sinh ra khí cacbon đioxit CO2 và nước. a) Lập phương trình hóa học phản ứng xảy ra? b) Cho biết tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phân tử cacbon đioxit. * Lời giải: a) Phương trình hóa học của phản ứng: C2H4 + 3O2 → 2CO2 + 2H2O. b) Số phân tử C2H4 : số phân tử oxi là 1 : 3 Số phân tử C2H4 : số phân tử cacbon đioxit = 1: 2 * Bài 5 trang 61 SKG Hóa 8: Cho sơ đồ của phản ứng như sau: Al + CuSO4 → Alx(SO4)y + Cu a) Xác định các chỉ số x và y. b) Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại số phân tử của cặp hợp chất. * Lời giải: a) Xác định các chỉ số x và y: – Ta có: Vậy x = 2, y= 3 ta có công thức: Al2(SO4)3 b) Phương trình hóa học: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu Tỉ lệ số nguyên tử của cặp đơn chất kim loại là số nguyên tử Al : số nguyên tử Cu = 2 : 3; Hy vọng với nội dung Bài tập luyện tập hiện tượng hóa học, phản ứng hóa học, định luật bảo toàn năng khối lượng và cách lập phương trình hóa học ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tốt. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





