Hóa 8 bài 11: Bài tập luyện tập Lập công thức hóa học và Quy tắc tính hóa trị của nguyên tố. Ở các bài trước các em đã dược học về cách lập công thức hóa học của hợp chất, và quy tắc tính hóa trị của các nguyên tốt trong hợp chất hóa học.
Bài viết này nhằm mục đích ôn lại các kiến thức về cách lập công thức hóa học và vận dụng quy tắc tính hóa trị của nguyên tố trong hợp chất để các em hiểu rõ hơn nội dung này.
This post: Hóa 8 bài 11: Bài tập luyện tập Lập công thức hóa học và Quy tắc tính hóa trị của nguyên tố
I. Kiến thức cần nhớ về cách lập công thức hóa học, quy tắc tính hóa trị
1. Chất được biểu diễn bằng công thức hóa học
• Đơn chất:
– A (kim loại và một vài phi kim như: S, C,…)
– Ax (phần lớn đơn chất phi kim, x = 2)
• Hợp chất: AxBy, AxByCz,…
• Mỗi công thức hóa học chỉ 1 phân tử của chất (trừ đơn chất A).
2. Hóa trị
• Hóa trị là con số biểu thị khả năng liên kết của nguyên tử hay nhóm nguyên tử.
Với hợp chất: 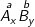
Trong đó: A, B là nguyên tử hay nhóm nguyên tử
a là hóa trị của A; b là hóa trị của B
Luôn có, quy tắc hóa trị: x.a = y.b.

a) Cách tính hóa trị chưa biết
* Thí dụ: H2S; Fe2(SO4)3
– Với H2S ta gọi b là hóa trị của S.
Từ công thức hóa học H2S theo quy tắc hóa trị, ta có:
2.I = 1.b suy ra 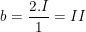
– Với Fe2(SO4)3 ta gọi a là hóa trị của Fe.
Từ công thức hóa họcFe2(SO4)3 theo quy tắc hóa trị, ta có:
2.a = 3.II suy ra 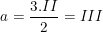
b) Cách lập công thức hóa học
– Từ quy tắc tính hóa trị của hợp chất 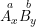 ta có:
ta có:
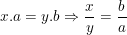
* Thí dụ: lập công thức hóa học
• 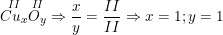 . Công thức hóa học là CuO.
. Công thức hóa học là CuO.
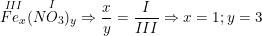 . Công thức hóa học là Fe(NO3)3.
. Công thức hóa học là Fe(NO3)3.
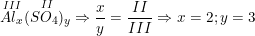 . Công thức hóa học là Al2(SO4)3.
. Công thức hóa học là Al2(SO4)3.
* Lưu ý:
– Khi a = b ⇒ x = 1; y = 1.
– Khi a ≠ b ⇒ x = b; y = a.
⇒ a, b, x, y là những số nguyên đơn giản nhất.
II. Bài tập vận dụng quy tắc tính hóa trị, lập công thức hóa học
* Bài 1 trang 41 SGK Hóa 8: Hãy tính hóa trị của đồng Cu, photpho P, silic Si, và sắt Fe trong các công thức hóa học sau: Cu(OH)2, PCl5, SiO2, Fe(NO3)3.
Biết các nhóm (OH), (NO3), Cl đều hóa trị I.
* Lời giải:
Gọi hóa trị của các chất cần tính là a. Ta có:
– Cu(OH)2: 1.a = I.2 ⇒ a = II.
Vậy Cu có hóa trị II.
– PCl5: 1.a = I.5 ⇒ a = V.
Vậy P có hóa trị V.
– SiO2: 1.a = II.2 ⇒ a = IV.
Vậy Si có hóa trị IV.
– Fe(NO3)3: 1.a = I.3 ⇒ a = III.
Vậy Fe có hóa trị III.
* Bài 2 trang 41 SGK Hóa 8: Cho biết công thức hóa học của hợp chất của nguyên tố X với O và hợp chất của nguyên tố Y với H như sau (X, Y là những nguyên tố nào đó): XO, YH3.
Hãy chọn công thức hóa học nào là đúng cho hợp chất của X với Y trong số các công thức sau đây:
A. XY3. B. X3Y. C. X2Y3. D. E. XY.
* Lời giải:
• Chọn đáp án: D. X3Y2.
– Gọi a hóa trị của X trong công thức 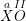 .
.
Theo quy tắc hóa trị ta có : a.1 = II.1 ⇒ a = II
⇒ X có hóa trị II
– Gọi b là hóa trị của Y trong công thức 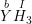 .
.
Theo quy tắc hóa trị ta có : b.1 = I.3 ⇒ b = 3
⇒ Y có hóa trị III
– Hợp chất X(II) và Y(III) có công thức dạng chung là 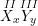
Theo quy tắc hóa trị ta có: II.x = III.y suy ra: 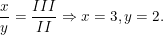
⇒ Công thức là X3Y2.
* Bài 3 trang 41 SGK Hóa 8: Theo hóa trị của sắt trong hợp chất có công thức hóa học là Fe2O3 hãy chọn công thức hóa học đúng trong số các công thức hợp chất có phân tử Fe liên kết với (SO4) hóa trị (II) sau:
A. FeSO4. B. Fe2SO4. C. Fe2(SO4)2. D. Fe2(SO4)3. E. Fe3(SO4)2.
* Lời giải:
• Chọn đáp án: D. Fe2(SO4)3.
– Gọi a hóa trị của Fe trong công thức 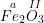 , ta có:
, ta có:
Theo quy tắc hóa trị ta có: a.2 = II.3 ⇒ a = III ⇒ Fe có hóa trị III
– Công thức dạng chung của Fe(III) và nhóm SO4 hóa trị (II) là 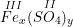
Theo quy tắc hóa trị ta có: III.x = II.y suy ra 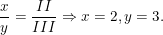
⇒ Công thức hóa học là Fe2(SO4)3.
* Bài 4 trang 41 SGK Hóa 8: Lập công thức hóa học và tính phân tử khối của hợp chất có phần tử gồm kali K(I), bari Ba(II), nhôm Al(III) lần lượt liên kết với:
a) Cl. b) Nhóm (SO4).
* Lời giải:
a) Gọi công thức hóa học chung của K(I) và Cl(I) là 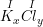
Theo quy tắc hóa trị ta có: 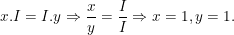
– Vậy CTHH của KxCly là KCl
– Phân tử khối của KCl là: 39 + 35,5 = 74,5 (đvC).
* Gọi công thức hóa học chung của Ba(II) và Cl(I) là 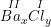
Theo quy tắc hóa trị ta có: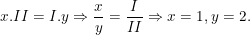
– Vậy CTHH của BaxCly là BaCl2
– Phân tử khối BaCl2 là: 137 + 35,5.2 = 208 (đvC).
* Gọi công thức hóa học chung của Al(III) và Cl(I) là 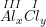
Theo quy tắc hóa trị ta có: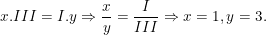
– Vậy CTHH của AlxCly là AlCl3
– Phân tử khối AlCl3 là: 27 + 35,5.3 = 133,5 (đvC).
b) Gọi công thức hóa học chung của K(I) và SO4(II) là 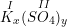
Theo quy tắc hóa trị ta có: 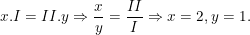
– Vậy CTHH của Kx(SO4)y là K2SO4
– Phân tử khối K2SO4 là: 39.2 + 32 + 16.4 = 174 (đvC).
* Gọi công thức hóa học chung của Ba(II) và SO4(II) là 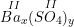
Theo quy tắc hóa trị ta có: 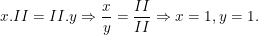
– Vậy CTHH của Bax(SO4)y là BaSO4
– Phân tử khối BaSO4 là: 137 + 32 + 16.4 = 233 (đvC).
* Gọi công thức hóa học chung của Al(III) và SO4(II) là 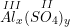
Theo quy tắc hóa trị ta có: 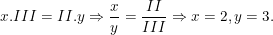
– Vậy CTHH của Alx(SO4)y là Al2(SO4)3
– Phân tử khối Al2(SO4)3 là: 27.2 + (32 + 16.4).3 = 342 (đvC).
Hy vọng với bài viết luyện tập về cách lập công thức hóa học và Quy tắc tính hóa trị của nguyên tố ở trên giúp các em hiểu rõ hơn khối kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết, Mầm Non Ánh Dương xin ghi nhận và chúc các em học tốt.
Xem thêm Hóa 8 bài 11
Hóa 8 bài 11: Bài tập luyện tập Lập công thức hóa học và Quy tắc tính hóa trị của nguyên tố. Ở các bài trước các em đã dược học về cách lập công thức hóa học của hợp chất, và quy tắc tính hóa trị của các nguyên tốt trong hợp chất hóa học. Bài viết này nhằm mục đích ôn lại các kiến thức về cách lập công thức hóa học và vận dụng quy tắc tính hóa trị của nguyên tố trong hợp chất để các em hiểu rõ hơn nội dung này. I. Kiến thức cần nhớ về cách lập công thức hóa học, quy tắc tính hóa trị 1. Chất được biểu diễn bằng công thức hóa học • Đơn chất: – A (kim loại và một vài phi kim như: S, C,…) – Ax (phần lớn đơn chất phi kim, x = 2) • Hợp chất: AxBy, AxByCz,… • Mỗi công thức hóa học chỉ 1 phân tử của chất (trừ đơn chất A). 2. Hóa trị • Hóa trị là con số biểu thị khả năng liên kết của nguyên tử hay nhóm nguyên tử. Với hợp chất: Trong đó: A, B là nguyên tử hay nhóm nguyên tử a là hóa trị của A; b là hóa trị của B Luôn có, quy tắc hóa trị: x.a = y.b. a) Cách tính hóa trị chưa biết * Thí dụ: H2S; Fe2(SO4)3 – Với H2S ta gọi b là hóa trị của S. Từ công thức hóa học H2S theo quy tắc hóa trị, ta có: 2.I = 1.b suy ra – Với Fe2(SO4)3 ta gọi a là hóa trị của Fe. Từ công thức hóa họcFe2(SO4)3 theo quy tắc hóa trị, ta có: 2.a = 3.II suy ra b) Cách lập công thức hóa học – Từ quy tắc tính hóa trị của hợp chất ta có: * Thí dụ: lập công thức hóa học • . Công thức hóa học là CuO. . Công thức hóa học là Fe(NO3)3. . Công thức hóa học là Al2(SO4)3. * Lưu ý: – Khi a = b ⇒ x = 1; y = 1. – Khi a ≠ b ⇒ x = b; y = a. ⇒ a, b, x, y là những số nguyên đơn giản nhất. II. Bài tập vận dụng quy tắc tính hóa trị, lập công thức hóa học * Bài 1 trang 41 SGK Hóa 8: Hãy tính hóa trị của đồng Cu, photpho P, silic Si, và sắt Fe trong các công thức hóa học sau: Cu(OH)2, PCl5, SiO2, Fe(NO3)3. Biết các nhóm (OH), (NO3), Cl đều hóa trị I. * Lời giải: Gọi hóa trị của các chất cần tính là a. Ta có: – Cu(OH)2: 1.a = I.2 ⇒ a = II. Vậy Cu có hóa trị II. – PCl5: 1.a = I.5 ⇒ a = V. Vậy P có hóa trị V. – SiO2: 1.a = II.2 ⇒ a = IV. Vậy Si có hóa trị IV. – Fe(NO3)3: 1.a = I.3 ⇒ a = III. Vậy Fe có hóa trị III. * Bài 2 trang 41 SGK Hóa 8: Cho biết công thức hóa học của hợp chất của nguyên tố X với O và hợp chất của nguyên tố Y với H như sau (X, Y là những nguyên tố nào đó): XO, YH3. Hãy chọn công thức hóa học nào là đúng cho hợp chất của X với Y trong số các công thức sau đây: A. XY3. B. X3Y. C. X2Y3. D. E. XY. * Lời giải: • Chọn đáp án: D. X3Y2. – Gọi a hóa trị của X trong công thức . Theo quy tắc hóa trị ta có : a.1 = II.1 ⇒ a = II ⇒ X có hóa trị II – Gọi b là hóa trị của Y trong công thức . Theo quy tắc hóa trị ta có : b.1 = I.3 ⇒ b = 3 ⇒ Y có hóa trị III – Hợp chất X(II) và Y(III) có công thức dạng chung là Theo quy tắc hóa trị ta có: II.x = III.y suy ra: ⇒ Công thức là X3Y2. * Bài 3 trang 41 SGK Hóa 8: Theo hóa trị của sắt trong hợp chất có công thức hóa học là Fe2O3 hãy chọn công thức hóa học đúng trong số các công thức hợp chất có phân tử Fe liên kết với (SO4) hóa trị (II) sau: A. FeSO4. B. Fe2SO4. C. Fe2(SO4)2. D. Fe2(SO4)3. E. Fe3(SO4)2. * Lời giải: • Chọn đáp án: D. Fe2(SO4)3. – Gọi a hóa trị của Fe trong công thức , ta có: Theo quy tắc hóa trị ta có: a.2 = II.3 ⇒ a = III ⇒ Fe có hóa trị III – Công thức dạng chung của Fe(III) và nhóm SO4 hóa trị (II) là Theo quy tắc hóa trị ta có: III.x = II.y suy ra ⇒ Công thức hóa học là Fe2(SO4)3. * Bài 4 trang 41 SGK Hóa 8: Lập công thức hóa học và tính phân tử khối của hợp chất có phần tử gồm kali K(I), bari Ba(II), nhôm Al(III) lần lượt liên kết với: a) Cl. b) Nhóm (SO4). * Lời giải: a) Gọi công thức hóa học chung của K(I) và Cl(I) là Theo quy tắc hóa trị ta có: – Vậy CTHH của KxCly là KCl – Phân tử khối của KCl là: 39 + 35,5 = 74,5 (đvC). * Gọi công thức hóa học chung của Ba(II) và Cl(I) là Theo quy tắc hóa trị ta có: – Vậy CTHH của BaxCly là BaCl2 – Phân tử khối BaCl2 là: 137 + 35,5.2 = 208 (đvC). * Gọi công thức hóa học chung của Al(III) và Cl(I) là Theo quy tắc hóa trị ta có: – Vậy CTHH của AlxCly là AlCl3 – Phân tử khối AlCl3 là: 27 + 35,5.3 = 133,5 (đvC). b) Gọi công thức hóa học chung của K(I) và SO4(II) là Theo quy tắc hóa trị ta có: – Vậy CTHH của Kx(SO4)y là K2SO4 – Phân tử khối K2SO4 là: 39.2 + 32 + 16.4 = 174 (đvC). * Gọi công thức hóa học chung của Ba(II) và SO4(II) là Theo quy tắc hóa trị ta có: – Vậy CTHH của Bax(SO4)y là BaSO4 – Phân tử khối BaSO4 là: 137 + 32 + 16.4 = 233 (đvC). * Gọi công thức hóa học chung của Al(III) và SO4(II) là Theo quy tắc hóa trị ta có: – Vậy CTHH của Alx(SO4)y là Al2(SO4)3 – Phân tử khối Al2(SO4)3 là: 27.2 + (32 + 16.4).3 = 342 (đvC). Hy vọng với bài viết luyện tập về cách lập công thức hóa học và Quy tắc tính hóa trị của nguyên tố ở trên giúp các em hiểu rõ hơn khối kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết, Mầm Non Ánh Dương xin ghi nhận và chúc các em học tốt. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục