Hoá 12 bài 32: Tính chất hoá học của Sắt 2, Sắt 3 oxit Sắt từ và hợp chất của Sắt. Trong bài trước chúng ta đã biết sắt có vai trò quan trọng trong đời sống và sản xuất vậy các hợp chất của sắt như sắt 2, sắt 3, oxit sắt từ và các hợp chất của sắt có tính chất hoá học và vai trò gì?
Bài viết này chúng ta cùng tìm hiểu về tính chất hoá học và tính chất vật lý của các hợp chất của sắt 2 và sắt 3 oxit, oxit sắt từ Fe3O4, làm sao để điều chế các một số hợp chất của sắt.
This post: Hoá 12 bài 32: Tính chất hoá học của Sắt 2, Sắt 3 oxit Sắt từ và hợp chất của Sắt
• xem thêm: Cách giải nhanh một số bài tập về sắt Fe và hỗn hợp của sắt
I. Hợp chất của sắt II – Fe (II)
– Trong các phản ứng hoá học ion Fe2+ dễ nhường 1e để trở thành ion Fe3+
Fe2+ + 1e → Fe3+
– Như vậy tính chất đặc trưng của hợp chất sắt 2 – Fe (II) là tính khử
1. Tính chất hoá học của Sắt (II) oxit – FeO
– Là chất rắn, đen, không tan trong nước.
– Tính chất hoá học:
+ FeO là oxit bazơ:
– FeO tác dụng với axit HCl: Fe + HCl
FeO + 2HCl → FeCl2 + H2↑
– FeO tác dụng với axit H2SO4: Fe + H2SO4
FeO + H2SO4 loãng → FeSO4 + H2O
+ FeO là chất oxi hóa khi tác dụng với các chất khử mạnh: H2, CO, Al → Fe:
– FeO tác dụng với H2: FeO + H2
FeO + H2 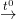 Fe + H2O
Fe + H2O
– FeO tác dụng với CO: FeO + CO
FeO + CO 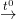 Fe + CO2
Fe + CO2
3FeO + 2Al 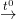 Al2O3 + 3Fe
Al2O3 + 3Fe
+ FeO là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
– FeO tác dụng với O2: FeO + O2
FeO + O2 → 2Fe2O3
– FeO tác dụng với axit HNO3: FeO + HNO3
3FeO + 10HNO3 loãng → 3Fe(NO3)3 + NO + 5H2O
– Điều chế FeO:
FeCO3 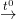 FeO + CO2 (nung trong điều kiện không có không khí)
FeO + CO2 (nung trong điều kiện không có không khí)
Fe(OH)2 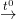 FeO + H2O (nung trong điều kiện không có không khí)
FeO + H2O (nung trong điều kiện không có không khí)
2. Oxit sắt từ Fe3O4 (FeO.Fe2O3)
– Là chất rắn, đen, không tan trong nước và có từ tính.
– Tính chất hoá học:
+ Fe3O4 là oxit bazơ:
– Fe3O4 tác dụng với axit HCl: Fe3O4 + HCl
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
– Fe3O4 tác dụng với axit HCl: Fe3O4 + H2SO4
Fe3O4 + 4H2SO4 loãng → Fe2(SO4)3 + FeSO4 + 4H2O
+ Fe3O4 là chất khử: Fe3O4 + HNO3
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑+ 14H2O
+ Fe3O4 là chất oxi hóa:
– Fe3O4 tác dụng với H2: Fe3O4 + H2
Fe3O4 + 4H2 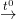 3Fe + 4H2O
3Fe + 4H2O
– Fe3O4 tác dụng với CO: Fe3O4 + CO
Fe3O4 + 4CO 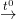 3Fe + 4CO2
3Fe + 4CO2
– Fe3O4 tác dụng với Al: Fe3O4 + Al
3Fe3O4 + 8Al 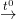 4Al2O3 + 9Fe
4Al2O3 + 9Fe
– Điều chế: thành phần quặng manhetit
3Fe + 2O2 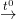 Fe3O4
Fe3O4
3Fe + 4H2O ![small xrightarrow[]{<570^{0}C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrow570_1550485394.gif) Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
3. Sắt (II) hidroxit Fe(OH)2
– Là chất kết tủa màu trắng xanh.
– Fe(OH)2 là bazơ không tan:
+ Fe(OH)2 Bị nhiệt phân:
Fe(OH)2 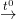 FeO + H2O (nung trong điều kiện không có không khí)
FeO + H2O (nung trong điều kiện không có không khí)
4Fe(OH)2 + O2 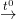 2Fe2O3 + 4H2O (nung trong không khí)
2Fe2O3 + 4H2O (nung trong không khí)
+ Tan trong axit không có tính oxi hóa → muối sắt (II) và nước:
– Fe(OH)2 tác dụng với HCl: Fe(OH)2 + HCl
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Có tính khử (do Fe có mức oxi hóa +2):
– Fe(OH)2 tác dụng với O2: Fe(OH)2 + O2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– Fe(OH)2 tác dụng với O2: Fe(OH)2 + HNO3
3Fe(OH)2 + 10HNO3 loãng → 3Fe(NO3)3 + NO + 8H2O
– Điều chế Fe(OH)2 :
Fe2+ + 2OH– → Fe(OH)2 (trong điều kiện không có không khí)
4. Muối sắt II
-Không bền, có tính khử, khi tác dụng với chất oxi hóa tạo thành muối sắt (III).
2FeCl2 + Cl2 → 2FeCl3
3Fe(NO3)2 + 4HNO3 → 3Fe(NO3)3 + NO + 2H2O
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
* Chú ý: Các muối sắt (II) không tan như FeCO3, FeS, FeS2 bị đốt nóng trong không khí tạo Fe2O3.
2FeCO3 + ½O2 → Fe2O3 + 2CO2
4FeS + 9O2 → 2Fe2O3 + 4SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
II. Hợp chất của sắt III – Fe (III)
– Trong các phản ứng hoá học ion Fe3+ có khả năng nhận 1e đến 3e để trở thành ion Fe2+ hoặc Fe:
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
– Như vậy tính chất đặc trưng của hợp chất sắt 3 – Fe (III) là tính oxi hóa.
1. Tính chất hoá học của Sắt (III) oxit – Fe2O3
– Là chất rắn, nâu đỏ, không tan trong nước.
– Tính chất hoá học:
+ Là oxit bazơ:
– Fe2O3 tác dụng với HCl: Fe2O3 + HCl
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
– Fe2O3 tác dụng với H2SO4 : Fe2O3 + H2SO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
– Fe2O3 tác dụng với H2SO4 : Fe2O3 + HNO3
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Là chất oxi hóa:
– Fe2O3 tác dụng với H2 : Fe2O3 + H2
Fe2O3 + 3H2 ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1550488256.gif) 2Fe + 3H2O
2Fe + 3H2O
– Fe2O3 tác dụng với CO : Fe2O3 + CO
Fe2O3 + 3CO ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1550488256.gif) 2Fe + 3CO2
2Fe + 3CO2
– Fe2O3 tác dụng với Al : Fe2O3 + Al
Fe2O3 + 2Al ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1550488256.gif) Al2O3 + 2Fe
Al2O3 + 2Fe
– Điều chế: thành phần của quặng hematit
2Fe(OH)3 ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1550488256.gif) Fe2O3 + 3H2O
Fe2O3 + 3H2O
2. Sắt (III) hidroxit Fe(OH)3
– Là chất kết tủa màu nâu đỏ.
– Tính chất hoá học:
+ Là bazơ không tan:
+ Bị nhiệt phân:
2Fe(OH)3 → Fe2O3 + 3H2O
+ Tan trong axit → muối sắt (III):
– Fe(OH)3 tác dụng với HCl : Fe(OH)3 + HCl
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
– Fe(OH)3 tác dụng với HNO3 : Fe(OH)3 + HNO3
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
– Điều chế Fe(OH)3:
Fe3+ + 3OH– → Fe(OH)3
3. Muối sắt (III)
– Có tính oxi hóa khi tác dụng với chất khử.
2FeCl3 + Cu → CuCl2 + 2FeCl2
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
2FeCl3 + H2S → 2FeCl2 + 2HCl + S
– Các dung dịch muối sắt (III) có môi trường axit:
Fe3+ + 3H2O ↔ Fe(OH)3 + 3H+
– Khi cho muối sắt (III) tác dụng với các kim loại cần lưu ý:
+ Nếu kim loại là Na, Ca, K, Ba + H2O → Kiềm + H2. Kiềm + Fe3+ → Fe(OH)3
+ Nếu kim loại không tan trong nước và đứng trước Fe + Fe3+ → Fe2+ → Fe
+ Nếu kim loại là Cu hoặc Fe + Fe3+ → Fe2+
– Các muối sắt (III) bị thủy phân hoàn toàn trong môi trường kiềm:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3 + 6NaCl + 3CO2
III. Bài tập về Sắt (II) oxit, sắt (III) oxit, oxit sắt từ và các hợp chất của sắt.
Bài 2 trang 145 sgk hóa 12: Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít khí H2 (đktc), dung dịch thu được cho bay hơi thu được tinh thể FeSO4.7H2O có khối lượng là 55,6 gam. Thể tích khí H2(đktc) được giải phóng là :
A. 8,19 lít. B. 7,33 lít.
C. 4,48 lít. D. 6,23 lít.
* Lời giải bài 2 trang 145 sgk hóa 12:
- Đáp án: C. 4,48 lít.
– Theo bài ra, cứ 278g FeSO4.7H2O có 152g FeSO4
⇒ Khối lượng FeSO4 trong 55,6g FeSO4.7H2O là:
mFeSO4 = (55,6.152)/278 = 30,4(g).
⇒ nFeSO4 = 30,4/152 = 0,2 (mol).
– PTPƯ: Fe + H2SO4 → FeSO4 + H2
– Theo phương trình phản ứng trên, ta có: nFe = nH2 = 0,2 (mol)
⇒ Vậy thể tích khí VH2 = 0,2.22,4 = 4,48 (lít)
Bài 3 trang 145 SGK Hóa 12: Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng sắt tham gia phản ứng là:
A. 1,9990 gam. B. 1,9999 gam.
C. 0,3999 gam. D. 2,1000 gam.
* Lời giải bài 3 trang 145 SGK Hóa 12:
- Đáp án: B. 1,9999 gam.
– Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
x mol x mol
– Dùng phương pháp tăng giảm khối lượng
⇒ ∆mtăng = mCu – mFe pư
⇔ (4,2875 – 4) = 64x – 56x
=> 8x = 0,2856
=> x = 0,0357125 (mol)
=> mFe pư = 0,0357125.56 = 1,999 (g)
– Theo PTPƯ thì cứ 56 gam Fe phản ứng tạo 64 gam Cu ⇒ khối lượng tăng : 64 – 56 = 8 (gam).
– Theo bài ra, cần x gam Fe khối lượng tăng : 4,2857 – 4 = 0,2857(gam).
=>8x = 56 . 0,2857
=>x = 1,9999.
Bài 4 trang 145 SGK Hóa 12: Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là:
A. 231 gam. B. 232 gam.
C. 233 gam. D. 234 gam.
* Lời giải bài 4 trang 145 SGK Hóa 12:
- Đáp án: B. 232 gam.
– Có thể coi 0,5 mol FeO và 0,5 mol Fe2O3 là 0,5 mol Fe3O4 . Vậy cả hỗn hợp có 1 mol Fe3O4 nên có khối lượng là 232g.
Hy vọng với bài viết về tính chất hóa học của sắt II, sắt III oxit sắt từ và các hợp chất của sắt ở trên hữu ích cho các bạn. Mọi thắc mắc và góp ý các em hãy để lại dưới phần bình luận để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục