Hóa 10 bài 24: Hợp chất có Oxi của Clo và Bài tập vận dụng. Oxi và Clo là là 2 nguyên tố có trong nước Gia-ven, đây là chất quen thuộc được dùng tẩy màu và sát trùng như: tẩy trắng vải, sợi, giấy và dùng để tẩy uế chuồng trại chăn nuôi, nhà vệ sinh.
Trong bài này chúng ta cùng tìm hiểu chi tiết về các hợp chất của Clo với Oxi như: nước Gia-ven và Clorua vôi có thành phần cấu tạo như thế nào? tính chất vật lý và tính chất hóa học của Clorua vôi ra sao? Chúng được dùng để làm gì và điều chế bằng cách nào?
This post: Hóa 10 bài 24: Hợp chất có Oxi của Clo và Bài tập vận dụng
I. Nước Gia-ven
1. Thành phần nước Gia-ven
– Nước Gia-ven là dung dịch hỗn hợp muối NaCl (natri clorua) và NaClO (natri hipoclorit).
2. Tính chất hóa học
– NaClO là muối của axit yếu (yếu hơn cả axit cacbonic), trong không khí nó tác dụng dần dần với CO2 tạo ra axit hipoclorơ HClO không bền:
NaClO + CO2 + H2O → NaHCO3 + HClO
– Cả NaClO và HClO trong dung dịch đều có tính oxi hóa rất mạnh.
3. Ứng dụng của nước Gia-ven
– Muối NaClO có tính oxi hóa mạnh vì vậy nước Gia-ven có tính tẩy màu và sát trùng thường được dùng để tẩy trắng vải, sợi, giấy tẩy uế chuồng trại chăn nuôi, nhà vệ sinh.
4. Điều chế nước Gia-ven
– Trong phòng thí nghiệm: Nước Gia-ven được điều chế bằng cách cho khí Clo tác dụng với dung dịch NaOH loãng ở nhiệt độ thường.
Cl2 + 2NaOH → NaCl + NaClO + H2O
⇒ Nước Gia-ven là hỗn hợp: NaCl + NaClO + H2O
– Trong công nghiệp: Nước Gia-ven được điều chế bằng cách điện phân dung dịch NaCl (nồng độ từ 15-20%) không có màng ngăn.
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
H2 ở catốt và Cl2 ở anốt; do không có màng ngăn nên ta có phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
II. Clorua vôi
1. Tính chất vật lí của clorua vôi
– Clorua vôi là chất bột màu trắng, xốp.
– Công thức phân tử (CTPT) của clorua vôi là: CaOCl2
– Cấu tạo của Clorua vôi là muối của kim loại Ca liên kết với 2 gốc axit là gốc Cl– và gốc ClO–.
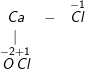
2. Tính chất hóa học của clorua vôi
– Tác dụng với chất khử:
CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O
– Tác dụng với CO2 trong không khí ẩm:
2CaOCl2 + CO2 + H2O → CaCO3↓ + CaCl2 + 2HClO
3. Điều chế clorua vôi
– Clorua vôi được điều chế bằng cách cho khí Clo đi qua vôi tôi hoặc sữa vôi ở 30oC.
Cl2 + Ca(OH)2 ![small xrightarrow[]{30^{0}C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/12/1575992052hca2kefk3d_1639447566-1.gif) CaOCl2 + H2O
CaOCl2 + H2O
III. Bài tập về hợp chất của Clo với Oxi
* Bài 1 trang 108 SGK Hóa 10: Chọn câu đúng trong các câu sau:
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối.
° Lời giải bài 1 trang 108 SGK Hóa 10:
• Chọn đáp án: B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
– Vì: 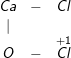
* Bài 2 trang 108 SGK Hóa 10: Nêu tính chất hóa học chính và ứng dụng của nước Gia-ven, clorua vôi.
° Lời giải bài 2 trang 108 SGK Hóa 10:
• Tính chất hóa học của nước Gia-ven:
– Nước Gia-ven là hỗn hợp muối NaCl và NaClO; NaClO là muối của axit yếu (yếu hơn cả axit cacbonic), trong không khí tác dụng với CO2 cho HClO không bền có tính oxi hóa mạnh.
NaClO + CO2 + H2O → NaHCO3 + HClO
2HClO → 2HCl + O2
– Nước Gia-ven có tính oxi hóa mạnh, không để được lâu.
• Tính chất hóa học của Clorua vôi.
– Clorua vôi có tính oxi hóa mạnh, khi tác dụng với dung dịch HCl giải phóng khí clo:
CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O
– Trong không khí ẩm, clorua vôi tác dụng với CO2:
2CaOCl2 + CO2 + H2O → CaCO3↓ + CaCl2 + 2HClO
• Ứng dụng của nước Gia-ven và Clorua vôi:
– Ứng dụng của nước Gia-ven: Nước Gia-ven có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. Nó cũng được dùng để khử mùi, sát trùng khi tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác.
– Ứng dụng của clorua vôi: Clorua vôi cũng được dùng để tẩy trắng sợi, vải, giấy để tẩy uế các hố rác, cống rãnh. Do có khả năng tác dụng với nhiều chất hữu cơ, clorua vôi dùng để xử lí các chất độc. Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ.
* Bài 3 trang 108 SGK Hóa 10: Trong phòng thí nghiệm có các hóa chất NaCl, MnO2, NaOH và H2SO4 đặc, ta có thể điều chế nước Gia-ven không? Viết các phương trình phản ứng.
° Lời giải bài 3 trang 108 SGK Hóa 10:
– Điều chế axit HCl từ NaCl, H2SO4 đặc, H2O:
NaCl + H2SO4 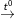 NaHSO4 + HCl
NaHSO4 + HCl
Hấp thụ khí hidro clorua vào nước được dung dịch axit HCl.
– Từ axit HCl và MnO2 điều chế Cl2:
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
– Từ Cl2 và dung dịch NaOH điều chế nước Gia – ven.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
(Nếu trong công nghiệp thì sẽ điện phân dung dịch NaCl không màng ngăn)
* Bài 4 trang 108 SGK Hóa 10: Có những sơ đồ phản ứng hóa học sau:
a) Cl2 + H2O → HCl + HClO
b) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
c) Cl2 + KOH → KCl + KClO3 + H2O
d) HCl + KClO3 → KCl + Cl2 + H2O
e) NaClO + CO2 + H2O → NaHCO3 + HClO
f) CaOCl3 → CaCl2 + O2
Cho biết những phản ứng nào là phản ứng oxi hóa – khử? Vai trò các chất tham gia phản ứng oxi hóa – khử. Hoàn thành phương trình hóa học của các phản ứng.
° Lời giải bài 4 trang 108 SGK Hóa 10:
– Các phản ứng (a,b,c,d,f) sau là phản ứng oxi hóa – khử:
a) 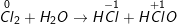
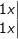
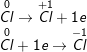
– Như vậy, Cl2 vừa là chất oxi hóa vừa là chất khử
b) 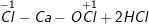
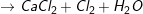
– CaOCl2 phân tử tự oxi hóa – khử, HCl đóng vai trò môi trường
c) 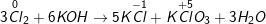
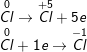
– Như vậy, Cl2 vừa là chất oxi hóa vừa là chất khử
d) 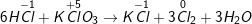
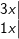
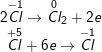
– HCl là chất khử, KClO3 là chất oxi hóa
f) 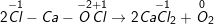
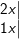
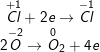
– CaOCl2 phân tử tự oxi hóa – khử.
* Bài 5 trang 108 SGK Hóa 10: Trong phòng thí nghiệm có canxi oxit, nước, MnO2, axit H2SO4 70% (D = 1,61 g/cm3) và NaCl. Hỏi cần phải dùng những chất gì và với lượng bao nhiêu để điều chế 254g clorua vôi?
° Lời giải bài 5 trang 108 SGK Hóa 10:
– Theo bài ra, cần điều chế 254g clorua vôi CaOCl2 nên có:
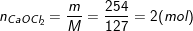
– Phương trình hóa học của các phản ứng:
CaO + H2O → Ca(OH)2 (1)
2(mol) 2(mol)
NaCl + H2SO4 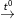 NaHSO4 + HCl (2)
NaHSO4 + HCl (2)
8(mol) 8(mol)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (3)
2(mol) 8(mol) 2(mol)
Cl2 + Ca(OH)2 → CaOCl2 + H2O (4)
2(mol) 2(mol) 2(mol)
– Theo PTPƯ (4) và (3), ta có:
nMnO2 = nCl2 = nCaOCl2 = 2(mol)
– Nên ta tính được: mMnO2 = 87.2 = 174(g).
– Theo PTPƯ (3) và (2), ta có:
nH2SO4 = nHCl = 4.nCl2 = 8(mol)
⇒ mH2SO4 = 8.98 = 784(g).
– Vậy khối dượng dung dịch H2SO4 70% cần dùng là:
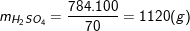
– Thể tích của dung dịch H2SO4 70% là:
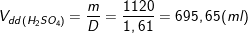
– Cũng theo PTPƯ (3) và (2) ta có: nNaCl = nHCl = 4.nCl2 = 8(mol).
⇒ mNaCl = 8.58,5 = 468(g).
– Theo PTPƯ (4) và (1), ta có: nCaO = nCa(OH)2 = nCaOCl2 = 2(mol).
⇒ mCaO = 2.56 = 112g.
Hy vọng với bài viết về Hợp chất có Oxi của Clo và Bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại nội dung dưới phần bình luận để thầy cô trường Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Xem thêm Hóa 10 bài 24
Hóa 10 bài 24: Hợp chất có Oxi của Clo và Bài tập vận dụng. Oxi và Clo là là 2 nguyên tố có trong nước Gia-ven, đây là chất quen thuộc được dùng tẩy màu và sát trùng như: tẩy trắng vải, sợi, giấy và dùng để tẩy uế chuồng trại chăn nuôi, nhà vệ sinh. Trong bài này chúng ta cùng tìm hiểu chi tiết về các hợp chất của Clo với Oxi như: nước Gia-ven và Clorua vôi có thành phần cấu tạo như thế nào? tính chất vật lý và tính chất hóa học của Clorua vôi ra sao? Chúng được dùng để làm gì và điều chế bằng cách nào? I. Nước Gia-ven 1. Thành phần nước Gia-ven – Nước Gia-ven là dung dịch hỗn hợp muối NaCl (natri clorua) và NaClO (natri hipoclorit). 2. Tính chất hóa học – NaClO là muối của axit yếu (yếu hơn cả axit cacbonic), trong không khí nó tác dụng dần dần với CO2 tạo ra axit hipoclorơ HClO không bền: NaClO + CO2 + H2O → NaHCO3 + HClO – Cả NaClO và HClO trong dung dịch đều có tính oxi hóa rất mạnh. 3. Ứng dụng của nước Gia-ven – Muối NaClO có tính oxi hóa mạnh vì vậy nước Gia-ven có tính tẩy màu và sát trùng thường được dùng để tẩy trắng vải, sợi, giấy tẩy uế chuồng trại chăn nuôi, nhà vệ sinh. 4. Điều chế nước Gia-ven – Trong phòng thí nghiệm: Nước Gia-ven được điều chế bằng cách cho khí Clo tác dụng với dung dịch NaOH loãng ở nhiệt độ thường. Cl2 + 2NaOH → NaCl + NaClO + H2O ⇒ Nước Gia-ven là hỗn hợp: NaCl + NaClO + H2O – Trong công nghiệp: Nước Gia-ven được điều chế bằng cách điện phân dung dịch NaCl (nồng độ từ 15-20%) không có màng ngăn. 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑ H2 ở catốt và Cl2 ở anốt; do không có màng ngăn nên ta có phản ứng: Cl2 + 2NaOH → NaCl + NaClO + H2O II. Clorua vôi 1. Tính chất vật lí của clorua vôi – Clorua vôi là chất bột màu trắng, xốp. – Công thức phân tử (CTPT) của clorua vôi là: CaOCl2 – Cấu tạo của Clorua vôi là muối của kim loại Ca liên kết với 2 gốc axit là gốc Cl- và gốc ClO-. 2. Tính chất hóa học của clorua vôi – Tác dụng với chất khử: CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O – Tác dụng với CO2 trong không khí ẩm: 2CaOCl2 + CO2 + H2O → CaCO3↓ + CaCl2 + 2HClO 3. Điều chế clorua vôi – Clorua vôi được điều chế bằng cách cho khí Clo đi qua vôi tôi hoặc sữa vôi ở 30oC. Cl2 + Ca(OH)2 CaOCl2 + H2O III. Bài tập về hợp chất của Clo với Oxi * Bài 1 trang 108 SGK Hóa 10: Chọn câu đúng trong các câu sau: A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit. B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit. C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit. D. Clorua vôi không phải là muối. ° Lời giải bài 1 trang 108 SGK Hóa 10: • Chọn đáp án: B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit. – Vì: * Bài 2 trang 108 SGK Hóa 10: Nêu tính chất hóa học chính và ứng dụng của nước Gia-ven, clorua vôi. ° Lời giải bài 2 trang 108 SGK Hóa 10: • Tính chất hóa học của nước Gia-ven: – Nước Gia-ven là hỗn hợp muối NaCl và NaClO; NaClO là muối của axit yếu (yếu hơn cả axit cacbonic), trong không khí tác dụng với CO2 cho HClO không bền có tính oxi hóa mạnh. NaClO + CO2 + H2O → NaHCO3 + HClO 2HClO → 2HCl + O2 – Nước Gia-ven có tính oxi hóa mạnh, không để được lâu. • Tính chất hóa học của Clorua vôi. – Clorua vôi có tính oxi hóa mạnh, khi tác dụng với dung dịch HCl giải phóng khí clo: CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O – Trong không khí ẩm, clorua vôi tác dụng với CO2: 2CaOCl2 + CO2 + H2O → CaCO3↓ + CaCl2 + 2HClO • Ứng dụng của nước Gia-ven và Clorua vôi: – Ứng dụng của nước Gia-ven: Nước Gia-ven có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. Nó cũng được dùng để khử mùi, sát trùng khi tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác. – Ứng dụng của clorua vôi: Clorua vôi cũng được dùng để tẩy trắng sợi, vải, giấy để tẩy uế các hố rác, cống rãnh. Do có khả năng tác dụng với nhiều chất hữu cơ, clorua vôi dùng để xử lí các chất độc. Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ. * Bài 3 trang 108 SGK Hóa 10: Trong phòng thí nghiệm có các hóa chất NaCl, MnO2, NaOH và H2SO4 đặc, ta có thể điều chế nước Gia-ven không? Viết các phương trình phản ứng. ° Lời giải bài 3 trang 108 SGK Hóa 10: – Điều chế axit HCl từ NaCl, H2SO4 đặc, H2O: NaCl + H2SO4 NaHSO4 + HCl Hấp thụ khí hidro clorua vào nước được dung dịch axit HCl. – Từ axit HCl và MnO2 điều chế Cl2: MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 – Từ Cl2 và dung dịch NaOH điều chế nước Gia – ven. Cl2 + 2NaOH → NaCl + NaClO + H2O. (Nếu trong công nghiệp thì sẽ điện phân dung dịch NaCl không màng ngăn) * Bài 4 trang 108 SGK Hóa 10: Có những sơ đồ phản ứng hóa học sau: a) Cl2 + H2O → HCl + HClO b) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O c) Cl2 + KOH → KCl + KClO3 + H2O d) HCl + KClO3 → KCl + Cl2 + H2O e) NaClO + CO2 + H2O → NaHCO3 + HClO f) CaOCl3 → CaCl2 + O2 Cho biết những phản ứng nào là phản ứng oxi hóa – khử? Vai trò các chất tham gia phản ứng oxi hóa – khử. Hoàn thành phương trình hóa học của các phản ứng. ° Lời giải bài 4 trang 108 SGK Hóa 10: – Các phản ứng (a,b,c,d,f) sau là phản ứng oxi hóa – khử: a) – Như vậy, Cl2 vừa là chất oxi hóa vừa là chất khử b) – CaOCl2 phân tử tự oxi hóa – khử, HCl đóng vai trò môi trường c) – Như vậy, Cl2 vừa là chất oxi hóa vừa là chất khử d) – HCl là chất khử, KClO3 là chất oxi hóa f) – CaOCl2 phân tử tự oxi hóa – khử. * Bài 5 trang 108 SGK Hóa 10: Trong phòng thí nghiệm có canxi oxit, nước, MnO2, axit H2SO4 70% (D = 1,61 g/cm3) và NaCl. Hỏi cần phải dùng những chất gì và với lượng bao nhiêu để điều chế 254g clorua vôi? ° Lời giải bài 5 trang 108 SGK Hóa 10: – Theo bài ra, cần điều chế 254g clorua vôi CaOCl2 nên có: – Phương trình hóa học của các phản ứng: CaO + H2O → Ca(OH)2 (1) 2(mol) 2(mol) NaCl + H2SO4 NaHSO4 + HCl (2) 8(mol) 8(mol) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (3) 2(mol) 8(mol) 2(mol) Cl2 + Ca(OH)2 → CaOCl2 + H2O (4) 2(mol) 2(mol) 2(mol) – Theo PTPƯ (4) và (3), ta có: nMnO2 = nCl2 = nCaOCl2 = 2(mol) – Nên ta tính được: mMnO2 = 87.2 = 174(g). – Theo PTPƯ (3) và (2), ta có: nH2SO4 = nHCl = 4.nCl2 = 8(mol) ⇒ mH2SO4 = 8.98 = 784(g). – Vậy khối dượng dung dịch H2SO4 70% cần dùng là: – Thể tích của dung dịch H2SO4 70% là: – Cũng theo PTPƯ (3) và (2) ta có: nNaCl = nHCl = 4.nCl2 = 8(mol). ⇒ mNaCl = 8.58,5 = 468(g). – Theo PTPƯ (4) và (1), ta có: nCaO = nCa(OH)2 = nCaOCl2 = 2(mol). ⇒ mCaO = 2.56 = 112g. Hy vọng với bài viết về Hợp chất có Oxi của Clo và Bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại nội dung dưới phần bình luận để thầy cô trường Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





