Hóa 10 bài 16: Bài tập luyện tập liên kết hóa học: So sánh liên kết ion và liên kết cộng hóa trị -. Các em đã tìm hiểu về các loại liên kết hóa học chính (liên kết ion và liên kết cộng hóa trị) để vận dụng giải thích sự hình thành một số loại phân tử. Đặc điểm cấu trúc và đặc điểm liên kết của 3 loại tinh thể.
Nội dung bài này giúp các em củng cố lại kiến thức trên, so sánh liên kết ion và liên kết cộng hóa trị; so sánh tinh thể ion, tinh thể nguyên tử và tinh thể phân tử. Rèn luyện kỹ năng xác định hóa trị và số oxi hóa của nguyên tố trong đơn chất và hợp chất.
This post: Hóa 10 bài 16: Bài tập luyện tập liên kết hóa học: So sánh liên kết ion và liên kết cộng hóa trị –
A. Liên kết hóa học: Kiến thức cần nắm vững
1. So sánh liên kết ion và liên kết cộng hóa trị
| Loại liên kết |
Liên kết ion |
Liên kết cộng hóa trị |
|
|
Không cực |
Có cực |
||
| Định nghĩa | – Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. | – Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. | |
| Bản chất của liên kết | – Electron chuyển từ nguyên tử này sang nguyên tử kia | – Đôi electron chung không lệch về nguyên tử nào. | – Đôi electron chung lệch về nguyên tử nào có độ âm điện lớn hơn. |
| Hiệu độ âm điện |
≥ 1,7 |
0 →< 0,4 |
0,4 →< 1,7 |
| Đặc tính |
Bền |
Bền |
|
Bảng So sánh liên kết ion và liên kết cộng hóa trị
2. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử
| Khái niệm | Tinh thể ion | Tinh thể nguyên tử | Tinh thể phân tử |
| – Các cation và anion được phân bố luân phiên đều đặn ở các điểm nút của mạng tinh thể ion. | – Ở các điểm nút của mạng tinh thể nguyên tử là những nguyên tử. | – Ở các điểm nút của mạng tinh thể phân tử là những phân tử | |
| Lực liên kết | – Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện. Lực này lớn. | – Các nguyên tử liên kết với nhau bằng lực liên kết cộng hóa trị. Lực này rất lớn. | – Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn nhiều lực hút tĩnh điện giữa các ion và lực liên kết cộng hóa trị. |
| Đặc tính | – Bền, khá rắn, khó bay hơi, khó nóng chảy. | – Bền, khá cứng, khó nóng chảy, khó bay hơi. | – Không bền, dễ nóng chảy, dễ bay hơi. |
Bảng So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử
B. Bài tập luyện tập liên kết hóa học
* Bài 1 trang 76 SGK Hóa 10: a) Viết phương tình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na → Na+ ; Cl → Cl–
Mg → Mg2+; S → S2-
Al → Al3+; O → O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
* Lời giải:
a) Na → Na+ + 1e;
Cl + 1e → Cl–
Mg → Mg2+ + 2e;
S + 2e → S2-
Al → Al3+ + 3e;
O +2e → O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl–: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
* Bài 2 trang 76 SGK Hóa 10: Trình bày sự giống nhau và khác nhau của 3 loại liên kết : Liên kết ion, liên kết cộng hóa trị không có cực và liên kết cộng hóa trị có cực.
* Lời giải:
| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |
| Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion | ||
* Bài 3 trang 76 SGK Hóa 10: Cho dãy oxit sau đây: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử trong phân tử hãy xác định loại liên kết trong từng phân tử oxit (tra giá trị độ âm điện ở bảng 6, trang 45).
* Lời giải:
Hiệu độ âm điện của các chất:
Na2O: 2,51 liên kết ion.
MgO: 2,13 liên kết ion.
Al2O3: 1,83 liên kết ion.
SiO2: 1,54 liên kết cộng hóa trị có cực
P2O5: 1,25 liên kết cộng hóa trị có cực
SO3: 0,86 liên kết cộng hóa trị có cực
Cl2O7: 0,28 liên kết cộng hóa trị không cực
* Bài 4 trang 76 SGK Hóa 10: a) Dựa vào giá trị độ âm điện (F: 3,98; O: 3,44; Cl: 3,16; N: 3,04) hãy xét xem tính phi kim thay đổi như thế nào của dãy nguyên tố sau : F, O, N, Cl.
b) Viết công thức cấu tạo của các phân tử sau đây: N2, CH4, H2O, NH3.
Xét xem phân tử nào có liên kết không phân cực, liên kết phân cực mạnh nhất.
* Lời giải:
a) Lập bảng độ âm điện
| Nguyên tố | F | O | Cl | N |
| Độ âm điện | 3,98 | 3,44 | 3,16 | 3,04 |
– Nhận xét: Tính phi kim của dãy nguyên tố : F, O, N, Cl giảm dần
b) Viết công thức cấu tạo của N2; CH4; H2O; và NH3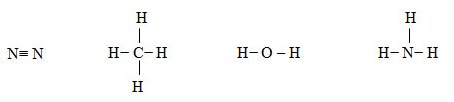
| N2 | CH4 | H2O | NH3 | |
| Hiệu độ âm điện | 0 | 0,35 | 1,24 | 0,84 |
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.
* Bài 5 trang 76 SGK Hóa 10: Một nguyên tử có cấu hình electron 1s22s22p3.
a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức phân tử của hợp chất khí với hiđro.
b) Viết công thức electron và công thức cấu tạo của phân tử đó.
* Lời giải:
a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là nitơ. Công thức phân tử hợp chất với hidro là NH3.
b) Công thức electron và công thức cấu tạo:
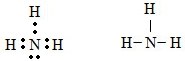
* Bài 6 trang 76 SGK Hóa 10: a) Lấy ví dụ về tinh thể ion, tinh thể nguyên tử, tinh thể phân tử.
b) So sánh nhiệt độ nóng chảy của các loại tinh thể đó. Giải thích.
c) Tinh thể nào dẫn điện được ở trạng thái rắn? Tinh thể nào dẫn điện được khi nóng chảy và khi hòa tan trong nước?
* Lời giải:
a) Tinh thể ion: NaCl; MgO; CsBr; CsCl.
– Tinh thể nguyên tử: Kim cương.
– Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit.
b) So sánh nhiệt độ nóng chảy: Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy.
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
– Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi.
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn. Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là tinh thể ion.
* Bài 7 trang 76 SGK Hóa 10: Xác định điện hóa trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với các nguyên tố nhóm IA.
* Lời giải:
– Điện hóa trị của các nguyên tố nhóm VIA, VIIA, trong các hợp chất vời nguyên tố nhóm IA là:
Các nguyên tố kim loại thuộc nhóm IA có số electron ở lớp ngoài cùng là 1, có thể nhường 1 electron này nên điện hóa trị là +1
Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6, 7 electron ở lớp ngoài cùng, có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng nên có điện hóa trị 2- hoặc 1-
* Bài 8 trang 76 SGK Hóa 10: a) Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, hãy nêu rõ trong các nguyên tố sau đây những nguyên tố nào có cùng cộng hóa trị trong các oxit cao nhất:
Si, P, Cl, S, C, N, Se, Br.
b) Những nguyên tố nào sau đây có cùng cộng hóa trị trong các hợp chất khí với hiđro.
P, S, F, Si, Cl, N, As, Te.
* Lời giải:
a) Những nguyên tố có cùng cộng hóa trị trong các oxit cao nhất:
RO2: Si, C
R2O5: P, N
RO3: S, Se
R2O7: Cl, Br
b) Những nguyên tố có cùng cộng hóa trị trong hợp chất khí với hidro:
RH4: Si
RH3: N, P, As
RH2: S, Te
RH: F, Cl
* Bài 9 trang 76 SGK Hóa 10: Xác định số oxi hóa của Mn, Cr, Cl, P, N, S, C, Br:
a) Trong phân tử : KMnO4, Na2Cr2O7 , KClO3, H3PO4.
b) Trong ion: NO3–, SO42-, CO32-, Br–, NH4+.
* Lời giải:
Xác định số oxi hóa:
a) Trong phân tử:
KMnO4: 1 + x + 4.(-2) = 0 ⇒ x = 7
⇒ Mn có số oxi hóa +7 trong phân tử KMnO4
Na2Cr2O7: 2. 1 + 2. x + 7.(-2 ) = 0 ⇒ x = 6
⇒ Cr có số oxi hóa + 6 trong phân tử Na2Cr2O7
KClO3: 1 + x + 3.(-2) = 0 ⇒ x = 5
⇒ Cl có số oxi hóa +5 trong hợp chất KClO3
H3PO4: 3. 1 + x + 4.(-2) = 0 ⇒ x = 5
⇒ P có số oxi hóa +5 trong hợp chất H3PO4
b) Trong ion:
NO3–: x + 3.(-2) = -1 ⇒ x = 5
⇒ N có số oxi hóa là +5 trong hợp chất NO3–.
SO42-: x + 4.(-2) = -2 ⇒ x = 6
⇒ S có số oxi hóa là +6.
CO32-: x + 3.(-2) = -2 ⇒ x = 4
⇒ C có số oxi hóa là +4.
Br–: Br có số oxi hóa là -1
NH4+: x + 4 = 1 ⇒ x = -3
⇒ N có số oxi hóa là -3.
Hy vọng với nội dung Bài tập luyện tập liên kết hóa học: So sánh liên kết ion và liên kết cộng hóa trị, tinh thể ion, nguyên tử và phân tử cùng kỹ năng xác định số oxi hóa và hóa trị của nguyên tố trong hợp chất này giúp các em củng cố được kiến thức đã học. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ.
Xem thêm Hóa 10 bài 16
Hóa 10 bài 16: Bài tập luyện tập liên kết hóa học: So sánh liên kết ion và liên kết cộng hóa trị -. Các em đã tìm hiểu về các loại liên kết hóa học chính (liên kết ion và liên kết cộng hóa trị) để vận dụng giải thích sự hình thành một số loại phân tử. Đặc điểm cấu trúc và đặc điểm liên kết của 3 loại tinh thể. Nội dung bài này giúp các em củng cố lại kiến thức trên, so sánh liên kết ion và liên kết cộng hóa trị; so sánh tinh thể ion, tinh thể nguyên tử và tinh thể phân tử. Rèn luyện kỹ năng xác định hóa trị và số oxi hóa của nguyên tố trong đơn chất và hợp chất. A. Liên kết hóa học: Kiến thức cần nắm vững 1. So sánh liên kết ion và liên kết cộng hóa trị Loại liên kết Liên kết ion Liên kết cộng hóa trị Không cực Có cực Định nghĩa – Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. – Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Bản chất của liên kết – Electron chuyển từ nguyên tử này sang nguyên tử kia – Đôi electron chung không lệch về nguyên tử nào. – Đôi electron chung lệch về nguyên tử nào có độ âm điện lớn hơn. Hiệu độ âm điện ≥ 1,7 0 →< 0,4 0,4 →< 1,7 Đặc tính Bền Bền Bảng So sánh liên kết ion và liên kết cộng hóa trị 2. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử Khái niệm Tinh thể ion Tinh thể nguyên tử Tinh thể phân tử – Các cation và anion được phân bố luân phiên đều đặn ở các điểm nút của mạng tinh thể ion. – Ở các điểm nút của mạng tinh thể nguyên tử là những nguyên tử. – Ở các điểm nút của mạng tinh thể phân tử là những phân tử Lực liên kết – Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện. Lực này lớn. – Các nguyên tử liên kết với nhau bằng lực liên kết cộng hóa trị. Lực này rất lớn. – Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn nhiều lực hút tĩnh điện giữa các ion và lực liên kết cộng hóa trị. Đặc tính – Bền, khá rắn, khó bay hơi, khó nóng chảy. – Bền, khá cứng, khó nóng chảy, khó bay hơi. – Không bền, dễ nóng chảy, dễ bay hơi. Bảng So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử B. Bài tập luyện tập liên kết hóa học * Bài 1 trang 76 SGK Hóa 10: a) Viết phương tình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng: Na → Na+ ; Cl → Cl- Mg → Mg2+; S → S2- Al → Al3+; O → O2- b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành. * Lời giải: a) Na → Na+ + 1e; Cl + 1e → Cl- Mg → Mg2+ + 2e; S + 2e → S2- Al → Al3+ + 3e; O +2e → O2- b) Cấu hình electron của các nguyên tử và các ion: 11Na : 1s22s22p63s1; Na+: 1s22s22p6 Cấu hình electron lớp ngoài cùng giống Ne. 17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6 Cấu hình electron lớp ngoài cùng giống Ar. 12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6 Cấu hình electron lớp ngoài cùng giống Ne. 16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6 Cấu hình electron lớp ngoài cùng giống Ar. 13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6 Cấu hình electron lớp ngoài cùng giống Ne. 😯 : 1s22s22p4; O2-: 1s22s22p6 Cấu hình electron lớp ngoài cùng giống Ne. * Bài 2 trang 76 SGK Hóa 10: Trình bày sự giống nhau và khác nhau của 3 loại liên kết : Liên kết ion, liên kết cộng hóa trị không có cực và liên kết cộng hóa trị có cực. * Lời giải: So sánh Liên kết ion Liên kết cộng hóa trị không có cực Liên kết cộng hóa trị có cực Giống nhau Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) Khác nhau về cách hình thành liên kết Cho và nhận electron Dùng chung e, cặp e không bị lệch Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn Khác nhau về nguyên tố tạo nên liên kết Giữa kim loại và phi kim Giữa các nguyên tử của cùng một nguyên tố phi kim Giữa phi kim mạnh và yếu khác Nhận xét Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion * Bài 3 trang 76 SGK Hóa 10: Cho dãy oxit sau đây: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử trong phân tử hãy xác định loại liên kết trong từng phân tử oxit (tra giá trị độ âm điện ở bảng 6, trang 45). * Lời giải: Hiệu độ âm điện của các chất: Na2O: 2,51 liên kết ion. MgO: 2,13 liên kết ion. Al2O3: 1,83 liên kết ion. SiO2: 1,54 liên kết cộng hóa trị có cực P2O5: 1,25 liên kết cộng hóa trị có cực SO3: 0,86 liên kết cộng hóa trị có cực Cl2O7: 0,28 liên kết cộng hóa trị không cực * Bài 4 trang 76 SGK Hóa 10: a) Dựa vào giá trị độ âm điện (F: 3,98; O: 3,44; Cl: 3,16; N: 3,04) hãy xét xem tính phi kim thay đổi như thế nào của dãy nguyên tố sau : F, O, N, Cl. b) Viết công thức cấu tạo của các phân tử sau đây: N2, CH4, H2O, NH3. Xét xem phân tử nào có liên kết không phân cực, liên kết phân cực mạnh nhất. * Lời giải: a) Lập bảng độ âm điện Nguyên tố F O Cl N Độ âm điện 3,98 3,44 3,16 3,04 – Nhận xét: Tính phi kim của dãy nguyên tố : F, O, N, Cl giảm dần b) Viết công thức cấu tạo của N2; CH4; H2O; và NH3 N2 CH4 H2O NH3 Hiệu độ âm điện 0 0,35 1,24 0,84 Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy. * Bài 5 trang 76 SGK Hóa 10: Một nguyên tử có cấu hình electron 1s22s22p3. a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức phân tử của hợp chất khí với hiđro. b) Viết công thức electron và công thức cấu tạo của phân tử đó. * Lời giải: a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là nitơ. Công thức phân tử hợp chất với hidro là NH3. b) Công thức electron và công thức cấu tạo: * Bài 6 trang 76 SGK Hóa 10: a) Lấy ví dụ về tinh thể ion, tinh thể nguyên tử, tinh thể phân tử. b) So sánh nhiệt độ nóng chảy của các loại tinh thể đó. Giải thích. c) Tinh thể nào dẫn điện được ở trạng thái rắn? Tinh thể nào dẫn điện được khi nóng chảy và khi hòa tan trong nước? * Lời giải: a) Tinh thể ion: NaCl; MgO; CsBr; CsCl. – Tinh thể nguyên tử: Kim cương. – Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit. b) So sánh nhiệt độ nóng chảy: Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy. – Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi. – Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi. c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn. Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là tinh thể ion. * Bài 7 trang 76 SGK Hóa 10: Xác định điện hóa trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với các nguyên tố nhóm IA. * Lời giải: – Điện hóa trị của các nguyên tố nhóm VIA, VIIA, trong các hợp chất vời nguyên tố nhóm IA là: Các nguyên tố kim loại thuộc nhóm IA có số electron ở lớp ngoài cùng là 1, có thể nhường 1 electron này nên điện hóa trị là +1 Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6, 7 electron ở lớp ngoài cùng, có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng nên có điện hóa trị 2- hoặc 1- * Bài 8 trang 76 SGK Hóa 10: a) Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, hãy nêu rõ trong các nguyên tố sau đây những nguyên tố nào có cùng cộng hóa trị trong các oxit cao nhất: Si, P, Cl, S, C, N, Se, Br. b) Những nguyên tố nào sau đây có cùng cộng hóa trị trong các hợp chất khí với hiđro. P, S, F, Si, Cl, N, As, Te. * Lời giải: a) Những nguyên tố có cùng cộng hóa trị trong các oxit cao nhất: RO2: Si, C R2O5: P, N RO3: S, Se R2O7: Cl, Br b) Những nguyên tố có cùng cộng hóa trị trong hợp chất khí với hidro: RH4: Si RH3: N, P, As RH2: S, Te RH: F, Cl * Bài 9 trang 76 SGK Hóa 10: Xác định số oxi hóa của Mn, Cr, Cl, P, N, S, C, Br: a) Trong phân tử : KMnO4, Na2Cr2O7 , KClO3, H3PO4. b) Trong ion: NO3-, SO42-, CO32-, Br-, NH4+. * Lời giải: Xác định số oxi hóa: a) Trong phân tử: KMnO4: 1 + x + 4.(-2) = 0 ⇒ x = 7 ⇒ Mn có số oxi hóa +7 trong phân tử KMnO4 Na2Cr2O7: 2. 1 + 2. x + 7.(-2 ) = 0 ⇒ x = 6 ⇒ Cr có số oxi hóa + 6 trong phân tử Na2Cr2O7 KClO3: 1 + x + 3.(-2) = 0 ⇒ x = 5 ⇒ Cl có số oxi hóa +5 trong hợp chất KClO3 H3PO4: 3. 1 + x + 4.(-2) = 0 ⇒ x = 5 ⇒ P có số oxi hóa +5 trong hợp chất H3PO4 b) Trong ion: NO3-: x + 3.(-2) = -1 ⇒ x = 5 ⇒ N có số oxi hóa là +5 trong hợp chất NO3-. SO42-: x + 4.(-2) = -2 ⇒ x = 6 ⇒ S có số oxi hóa là +6. CO32-: x + 3.(-2) = -2 ⇒ x = 4 ⇒ C có số oxi hóa là +4. Br-: Br có số oxi hóa là -1 NH4+: x + 4 = 1 ⇒ x = -3 ⇒ N có số oxi hóa là -3. Hy vọng với nội dung Bài tập luyện tập liên kết hóa học: So sánh liên kết ion và liên kết cộng hóa trị, tinh thể ion, nguyên tử và phân tử cùng kỹ năng xác định số oxi hóa và hóa trị của nguyên tố trong hợp chất này giúp các em củng cố được kiến thức đã học. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục