OLEUM LÀ GÌ?
Oleum có công thức hóa học là ySO3.H2O với y là tổng hàm lượng mol lưu huỳnh trioxit. Nó cũng có thể được biểu thị theo công thức H2SO4.xSO3 với x được định nghĩa là hàm lượng mol lưu huỳnh trioxit tự do. Nó tác dụng với nước sinh ra H2SO4 đặc nóng: H2SO4.nSO3 + H2O → H2SO4.
Oleum có nghĩa là axit sunfuric bóc khói (vì có khói giống khói của dầu).
This post: Công thức oleum

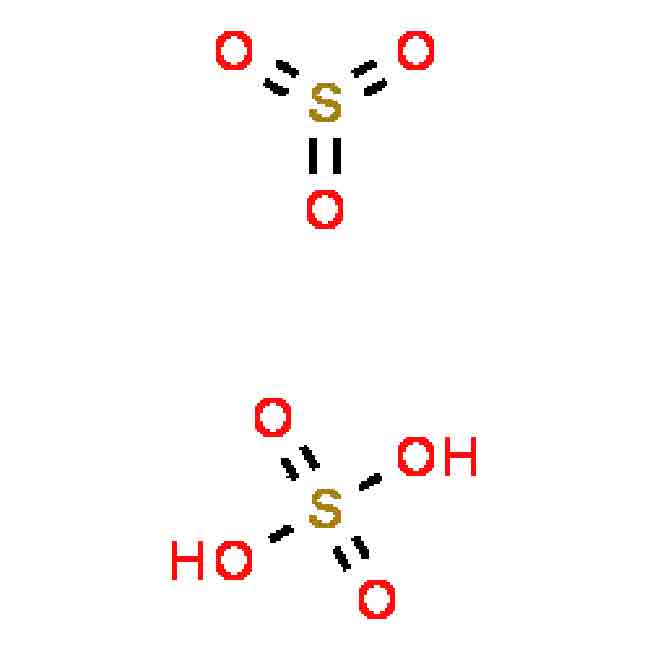
Oleum là tên gọi của axit sunfuric được biểu thị theo công thức H2SO4.nSO3 với n được định nghĩa là hàm lượng mol lưu huỳnh trioxit tự do.
Tên gọi khác: axit Nordhausen, axit sunfuric bốc khói.
Hỗn hợp giữa SO3 với H2O đều gọi là axit sunfuric. Nếu tỷ lệ này SO3/H2O 1 được gọi là oleum.
Nồng độ của Oleum hoặc được biểu diễn theo % của SO3 (gọi là % oleum).
Các nồng độ chủ yếu thường gặp của Oleum là 40% oleum (109% H2SO4) và 65% oleum (114,6% H2SO4).
Sản xuất
Oleum được sản xuất trong quá trình tiếp xúc, trong đó lưu huỳnh bị oxy hóa thành lưu huỳnh trioxide, sau đó được hòa tan trong axit sunfuric đậm đặc. Axit sulfuric tự nó được tái sinh bằng cách pha loãng một phần của oleum.
Vì SO3 có thể tan trong H2SO4 tạo H2SO4.nSO3 (oleum), oleum xuất hiện nhiều nhất trong giai đoạn SO3 +H2O → H2SO4.
Axit trong giai đoạn này là axit đậm đặc sau đó được pha loãng.
Phản ứng: H2S2O7 → H2SO4 + SO3
Ứng dụng
Sản xuất axit sunfuric
Oleum là một chất trung gian quan trọng trong sản xuất axit sunfuric do khả năng hydrat hóa cao. Khi SO3 được thêm vào nước, thay vì hòa tan, nó có xu hướng tạo thành một màn sương mịn của axit sulfuric, rất khó quản lý. Tuy nhiên, SO3 được thêm vào axit sunfuric đậm đặc dễ dàng hòa tan, tạo thành quầng sau đó có thể được pha loãng với nước để tạo ra axit sunfuric đậm đặc bổ sung.
Là một trung gian cho giao thông vận tải
Oleum là một hình thức hữu ích để vận chuyển các hợp chất axit sunfuric, điển hình là trong các toa xe lửa, giữa các nhà máy lọc dầu (sản xuất các hợp chất lưu huỳnh khác nhau như một sản phẩm phụ của quá trình tinh chế) và người tiêu dùng công nghiệp.
Một số thành phần của oleum là rắn ở nhiệt độ phòng, và do đó an toàn hơn khi vận chuyển hơn là chất lỏng. Chất rắn có thể được chuyển đổi thành chất lỏng tại điểm đến bằng cách làm nóng bằng hơi nước hoặc pha loãng hoặc nồng độ. Điều này đòi hỏi phải cẩn thận để ngăn chặn quá nhiệt và bay hơi của trioxide lưu huỳnh. Để trích xuất nó từ một chiếc xe tăng đòi hỏi phải sưởi ấm cẩn thận bằng cách sử dụng ống dẫn hơi bên trong xe tăng. Phải hết sức cẩn thận để tránh quá nóng, vì điều này có thể làm tăng áp suất trong xe bồn vượt quá giới hạn van an toàn của xe tăng.
Ngoài ra, oleum ít ăn mòn kim loại hơn axit sulfuric, vì không có nước tự do để tấn công các bề mặt. Do đó, axit sunfuric đôi khi được cô đặc thành đường cho các đường ống trong nhà máy và sau đó được pha loãng trở lại thành axit để sử dụng trong các phản ứng công nghiệp.
Tại Richmond, California vào năm 1993, một sự phóng thích đáng kể đã xảy ra do quá nóng, gây ra sự giải phóng lưu huỳnh trioxide hấp thụ độ ẩm từ khí quyển, tạo ra một màn sương của các hạt axit sulfuric có kích thước micromet tạo thành mối nguy hại cho sức khỏe đường hô hấp. Sương mù này lan rộng trên một khu vực rộng.
Nghiên cứu hóa học hữu cơ
Oleum là một thuốc thử khắc nghiệt, có tính ăn mòn cao. Một công dụng quan trọng của oleum làm thuốc thử là quá trình nitrat hóa thứ cấp của nitrobenzene. Quá trình nitrat hóa đầu tiên có thể xảy ra với axit nitric trong axit sunfuric, nhưng điều này làm mất tác dụng của vòng theo hướng thay thế điện di. Một thuốc thử mạnh hơn, oleum, là cần thiết để đưa nhóm nitro thứ hai vào vòng
Sản xuất thuốc nổ
Oleum được sử dụng trong sản xuất nhiều chất nổ với ngoại lệ đáng chú ý là nitrocellulose. (Trong sản xuất hiện đại của nitrocellulose, nồng độ H2SO4 thường được điều chỉnh bằng cách sử dụng oleum.) Các yêu cầu hóa học đối với sản xuất thuốc nổ thường yêu cầu hỗn hợp khan có chứa axit nitric và axit sunfuric. Axit nitric thương mại thông thường bao gồm azeotrope sôi liên tục của axit nitric và nước, và chứa 68% axit nitric. Do đó, hỗn hợp axit nitric thông thường trong axit sunfuric chứa một lượng nước đáng kể và không phù hợp với các quá trình như những quá trình xảy ra trong quá trình sản xuất trinitrotoluene.
Việc tổng hợp RDX và một số chất nổ khác không cần phải sử dụng.

Axit nitric khan, được gọi là axit nitric bốc khói trắng, có thể được sử dụng để điều chế hỗn hợp nitrat không có nước, và phương pháp này được sử dụng trong các hoạt động ở quy mô phòng thí nghiệm trong đó chi phí nguyên liệu không quan trọng. Axit nitric bốc khói rất nguy hiểm khi xử lý và vận chuyển, vì nó cực kỳ ăn mòn và dễ bay hơi. Đối với sử dụng trong công nghiệp, các hỗn hợp nitrat mạnh như vậy được điều chế bằng cách trộn ole với axit nitric thương mại thông thường để lưu huỳnh tự do trong lưu huỳnh tiêu thụ nước trong axit nitric
Phản ứng
Giống như axit sunfuric đậm đặc, oleum là một chất khử nước mạnh đến mức nếu đổ vào glucose bột hoặc hầu như bất kỳ loại đường nào khác, nó sẽ hút các nguyên tố nước ra khỏi đường trong phản ứng tỏa nhiệt, để lại gần như carbon nguyên chất. Cacbon này mở rộng ra bên ngoài, cứng lại như một chất đen đặc với bọt khí trong đó.
Bài tập xác định công thức Oleum
Các kiến thức cần nhớ:
- Oleum có công thức là H2SO4.nSO2. Khi Oleum tác dụng với nước ta có: (n+1)H2SO4.
⇒ noleum = nH2SO4/n+1
- Khi pha trộn dung dịch oleum có thể xem là một axit có nồng độ: [(n+1)98]/(98 + 80n)
- Muốn xác định công thức của Oleum cần xác định được nH2SO4 : NSO3
Bài tập 1:
Xác định công thức của Oleum A, biết rằng cần phải dùng 800ml dung dịch KOH 0,1M để trung hòa đươc dung dịch A khi hòa tan 3,38 gam A vào nước.
Bài giải:
Gọi CT của Oleum là H2SO4.nSO3
Ta có:
H2SO4 + 2KOH → K2SO4 + 2H2O
0,04 mol ← 0,08 mol
H2SO4.nSO3 + nH2O → (n+1) H2SO4
nH2SO4.nSO3 = nH2SO4/(n+1)= 0,04/(n +1)
Mặt khác:
nH2SO4.nSO3 = 3,38/(98 + 80n)
⇒ 0,04/(n+1) = 3,38/(98 + 80n) ⇒ n=3
Vậy công thức của oleum A là H2SO4.3SO3
Bài tập 2:
Cho 0,015 mol một loại hợp chất Oleum vào nước ta thu được 200ml dung dịch X. Cần 200ml dung dịch NaOH 0,15M để trung hòa 100ml dung dịch X. Tính phần trăm khối lượng nguyên tố lưu huỳnh có trong Oleum trên.
Bài giải:
Gọi CT của Oleum là H2SO4.nSO3.
Ta có: nNaOH = 0,2.0,15 = 0,03 mol (trong 100ml dung dịch X)
Trong 100ml X: H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,015 ← 0,03
Ở trong 200ml X: H2SO4.nSO3 + nH2O → (n+1) H2SO4
0,015 → 0,03
⇒ (n+1)/1 = 0,03/0,015 = 2 → n=1 → oleum có CT: H2SO4.SO3
⇒ %ms = [32,2/(98+80)]100% = 35,95%
Vậy trong Oluem có 35,95% khối lượng nguyên tố lưu huỳnh
Bài tập 3:
Hòa an hết 1,69 gam oleum với công thức H2SO4.3SO3 vào nước dư. Để trung hòa dung dịch thu được cần X ml dung dịch KOH 1M. Vậy X bằng bao nhiêu?
Bài giải:
Ta có: nH2SO4.3SO3 = 1,69/338 = 5.10-3 mol
PTHH: H2SO4.3SO3 + 3H2O → 4H2SO4
5.10-3 → 0,02
H2SO4 + 2KOH → K2SO4 + 2H2O
0,02 → 0,04
⇒ XKOH = (0,04/1)1000 = 40ml
Vậy cần 40ml dung dịch KOH 1M
Bài tập 4:
Thu được một loại Oleum có phần trăm khối lượng SO3 là 40,82% sau khi cho hấp thụ m gam SO3 vào trong 100 gam dung dịch H2SO4 96,4%. Tính m?
Bài giải:
Dung dịch H2SO4 ban đầu sẽ có: mH2SO4 = 96,4 gam và mH2O = 3,6 gam
⇒ nH2O = 0,02 mol
Ta có PTPƯ:
SO3 + H2O → H2SO4
0,2 mol ← 0,2mol → 0,2 mol
mSO3 = m – 0,2.80 (g)
C%SO3 = [mSO3/(100 + m)].100% = [(m-16)/(100 + m)].100% = 40,82%
⇒ m = 96
Bài tập 5:
Sau khi hòa tan 8,45 gam oleum A vào nước thu được dung dịch B. Cần 200ml dung dịch NaOH 1M để trung hòa dung dịch B. Xác định công thức Oleum A.
Bài giải:
Gọi công thức của A là H2SO4.nSO3
Ta có:
nH2SO4 (trong dung dịch B) = (1 + n) . nH2SO4.nSO3
⇒ nH2SO4.nSO3 = nH2SO4 (trong dung dịch B)/n +1
Để trung hòa B cần 0,2 mol NaOH
2NaOH + H2SO4 → Na2SO4 + H2O
0,2 mol -> 0,1 mol
⇒ nH2SO4.nSO3 = nH2SO4 (trong dd B)/n + 1 = 0,1/n + 1
Mặt khác: nH2SO4.nSO3 = 8,45/98 + 80n
⇒ 0,1/n +1 = 8,45/98 + 80n ⇒ n = 3
Vậy công thức của A là H2SO4.3SO3
Bài 9 trang 191 Hóa học 10 Nâng cao: Oleum là gì?
Bài 46: Luyện tập chương 6 – Bài 9 trang 191 SGK Hóa học 10 Nâng cao. Oleum là gì?
Oleum là gì?
a) Hãy xác định công thức của oleum A, biết rằng sau khi hòa tan 3,38 g A vào nước, người ta phải dùng 800ml dung dịch KOH 0,1M để trung hòa dung dịch A.
b) Cần hòa tan bao nhiêu gam oleum A vào 200g nước để được dung dịch H2SO4 10%.
Đáp án
Oleum là dung dịch H2SO498%H2SO498% hấp thụ SO3 được oleum H2SO4.nSO3.
H2SO4+nSO3→H2SO4.nSO3H2SO4+nSO3→H2SO4.nSO3
a) Xác định công thức oleum.
H2SO4+2KOH→K2SO4+2H2O(1)0,04←0,08H2SO4+2KOH→K2SO4+2H2O(1)0,04←0,08
Ta có nKOH = 0,8.0,1 = 0,08 (mol)
Khi hòa tan oleum vào nước có quá trình
H2SO4.nSO3+nH2O→(n+1)H2SO4(2)H2SO4.nSO3+nH2O→(n+1)H2SO4(2)
Từ (2) và đề bài ta có 98+80n3,38=n+10,0498+80n3,38=n+10,04
Giải ra được n = 3. Vậy công thức phân tử oleum là H2SO4.3SO3.
b) Gọi a là số mol oleum H2SO4.3SO3.
Moleum = 98 + 240=338u ⇒moleum=338a
Khi hòa tan oleum vào nước có phản ứng sau:


Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục