Cấu hình electron nguyên tử: lý thuyết, cách viết cấu hình e
Chủ đề hôm nay chúng ta sẽ nghiên cứu về cấu hình electron. Mở đầu cho kiến thức lớp 10 và ôn lại một số nội dung mà chúng ta đã học khi mới làm quen với bộ môn hóa học lớp 8. Chúng ta sẽ tìm hiểu lần lượt, từ cấu hình electron nguyên tử, đặc điểm của lớp electron ngoài cùng, đến cách viết cấu hình electron và một số ví dụ áp dụng. Nào chúng ta cùng tìm hiểu nhé!
Nội dung chính
This post: Cấu hình electron nguyên tử: lý thuyết, cách viết cấu hình e
Lý thuyết về cấu hình electron
Cấu hình electron nguyên tử
– Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
– Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron bằng các chữ số: 1, 2, 3
+ Phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f
+ Số electron trong phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp: s2, p6, d10…
– Cách viết cấu hình electron nguyên tử:
+ Xác định số electron của nguyên tử.
+ Các electron được phân bố theo thứ tự tăng dần các mức năng lượng AO, tuân theo các nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun.
+ Viết cấu hình electron theo thứ tự các phân lớp trong 1 lớp và theo thứ tự của các lớp electron.
+ Lưu ý: các electron được phân bố vào các AO theo phân mức năng lượng tăng dần và có sự chèn mức năng lượng. Tuy nhiên, khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Ví dụ: Nguyên tử Fe có Z= 26.
+ Có 26e
+ Các e được phân bố như sau: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Có sự chèn mức năng lượng 4s < 3d
+ Sắp xếp lại các phân lớp theo từng lớp, ta được cấu hình e: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Hoặc viết gọn: [Ar] 3d6 4s2 ( [Ar] là cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước Fe )
Đặc điểm lớp electron ngoài cùng
– Các electron ở lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố:
+ Số electron tối đa ở lớp ngoài cùng của nguyên tử mỗi nguyên tố là 8 electron. Các nguyên tử có 8e lớp ngoài cùng đều rất bền vững, chúng hầu như không tham gia vào các phản ứng hóa học. Đó là các nguyên tử khí hiếm ( trừ He có 2e lớp ngoài cùng ).
+ Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.
+ Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim.
+ Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim.
Cách viết cấu hình electron
Nguyên lí và quy tắc cần nhớ
Để viết được cấu hình electron, đầu tiên chúng ta cần nắm chắc những nguyên lý và quy tắc sau:
+ Nguyên lý Pauli: Trên một obital nguyên tử chỉ có thể chứa tối đa là hai electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các obital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
+ Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các obital có mức năng lượng từ thấp đến cao
Các bước viết cấu hình e
Bước 1: Xác định số e của nguyên tử (Z).
Bước 2: Sắp xếp các e theo thứ tự tăng dần mức năng lượng:
1s 2s 2p 3s 3p 4s 3d 4p 5s…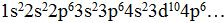
Bước 3: Sắp xếp cấu hình e: theo thứ tự từng lớp (1→7), trong mỗi lớp theo thứ tự từng phân lớp (s→p→d→f).
Ví dụ: Na (Z=11):
B1: E=Z= 11
B2: 1s2 2s2 2p6 3s1
B3: 1s2 2s2 2p6 3s1
Ví dụ minh họa
Ví dụ 1: Viết Cấu hình electron của nguyên tử các nguyên tố sau:
a) Cl (Z=17)
B1: E=Z= 17
B2: 1s2 2s2 2p6 3s2 3p5
B3: 1s2 2s2 2p6 3s2 3p5
b) Ne ( Z=10)
B1: E=Z=10
B2: 1s2 2s2 2p6
B3: 1s2 2s2 2p6
c) O (Z=8)
B1: E=Z=8
B2: 1s2 2s2 2p4
B3: 1s2 2s2 2p4
d) Ar (Z=18)
B1: E=Z=18
B2: 1s2 2s2 2p6 3s2 3p6
B3: 1s2 2s2 2p6 3s2 3p6
Ví dụ 2: Cho biết số electron tối đa trong 1 lớp, 1 phân lớp
Hướng dẫn:
*Số electron tối đa trong một phân lớp
+ Phân lớp s chứa tối đa 2e
+ Phân lớp p chứa tối đa 6e
+ Phân lớp d chứa tối đa 10e
+ Phân lớp f chứa tối đa 14e
* Số electron tối đa trong một lớp
+ Lớp thứ nhất có tối đa 2e
+ Lớp thứ hai có tối đa 8e
+ Lớp thứ ba có tối đa 18e
Ví dụ 3: Nguyên tử X có ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của nguyên tố X có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố X có 30 nơtron trong hạt nhân.
(3) X là một phi kim.
(4) X là nguyên tố d.
Trong các phát biểu trên, những phát biểu đúng là?
A. (1), (2), (3) và (4).
B. (1), (2) và (4).
C. (2) và (4).
D. (2), (3) và (4).
Hướng dẫn:
Do có sự chèn mức NL nên electron được phân bố như sau:
1s22s22p63s23p6 4s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay [Ar] 3d64s2
– Số e lớp ngoài cùng là 2 do đó X là Kim loại
– N = A – Z = 56 – 26 = 30
– Electron cuối cùng phân bố trên phân lớp 3d nên X là nguyên tố d.
⇒ Chọn C.
Ví dụ 4: Cấu hình electron của nguyên tử nguyên tố X có dạng [Ne]3s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Hướng dẫn:
⇒ Chọn C.
Ví dụ 5: Một nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X. Viết cấu hình e của X
Hướng dẫn:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Ví dụ 6: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tổng số electron s và electron p của nguyên tố này là
Hướng dẫn:
Nguyên tố d có 4 lớp electron → electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dX4s2.
Vậy tổng số electron s và electron p là 20.
Những kiến thức về lý thuyết và cách viết cấu hình electron với một số ví dụ minh họa. Để học tốt dạng bài này, các em nên sưu tầm thêm một số tài liệu để áp dụng ngay những kiến thức trong bài học này nhé! Chúc các em học tốt.
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục