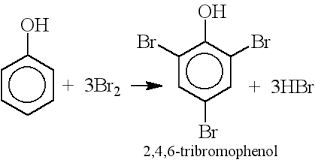
Bài tập xác định tên của kim loại và một trong những dạng bài tập khá phổ biến trong nội dung hóa học vô cơ lớp 12. Các em có thể dễ dàng kiếm điểm đối với dạng bài này khi chúng xuất hiện trong đề thi.
Vậy cách giải dạng bài tập xác định tên của kim loại như thế nào? chúng ta sẽ cùng đi tìm hiểu qua bài viết dưới đây.
This post: Cách giải Bài tập xác định tên Kim loại – Hóa 12 chuyên đề
I. Cách giải bài tập xác định tên kim loại
– Mỗi nguyên tố có một số điện tích hạt nhân Z và khối lượng mol nguyên tử xác định M. Do đó tùy theo bài toán mà tìm cách xác định: Z hoặc M.
* Lưu ý: Nếu bài toán thiếu dữ kiện (giả sử hóa trị của kim loại chưa biết) thì tìm sự phụ thuộc của M theo hóa trị n rồi rựa vào điều kiện của n (nguyên, 1 ≤ n ≤ 3) để tìm M.
– Dạng bài này thường sử dụng phương pháp trung bình, định luật bảo toàn khối lượng, định luật bảo toàn electron,..
* Phương pháp trung bình thường sử dụng khi:
– Trong các bài tập có hai hay nhiều chất cùng thành phần hóa học, phản ứng tương tự nhau, ta có thể thay chúng bằng một chất có công thức chung, như vậy việc tính toán sẽ rút gọn được số ẩn.
– Khối lượng phân tử trung bình của một hỗn hợp là khối lượng của 1 mol hỗn hợp đó:
II. Bài tập xác định tên kim loại
* Bài tập 1: Để hòa tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hóa trị II) và oxit của nó cần vừa đủ 400ml dung dịch HCl 1M. Xác định R?
* Lời giải:
– Đổi đơn vị: 400ml = 0,4lít;
– Kim loại R có hóa trị II nên oxit của nó là RO
– Ta có PTHH sau:
R + HCl → RCl2 + H2↑
RO + 2HCl → RCl2 + H2O
– Theo bài ra, ta có: nHCl = CM.V = 1.0,4 = 0,4(mol).
– Theo bài ra, phản ứng xảy ra vừa đủ và từ PTHH:
⇒ n(R, RO) = 0,2(mol)
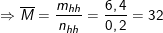
Vậy suy ra: MR < 32 < MR + 16
⇒ 16 < MR < 32 ⇒ MR = 24≡Mg
Vậy kim loại là Mg hợp chất với oxi là MgO.
* Ví dụ 2: Nhúng 1 lá kim loại M (chỉ có hóa trị II trong hợp chất) có khối lượng 50gam vào 200ml dung dịch AgNO3 1M cho đến khi phản ứng xảy ra hoàn toàn. Lọc dung dịch, đem cô cạn thu được 18,8 gam muối khan. Xác định kim loại M?
* Lời giải:
– Đổi đơn vị 200ml = 0,2lít;
– Theo bải ra, ta có: nAgNO3 = CM.V = 1.0,2 = 0,2(mol)
– Suy ra khối lượng AgNO3 là: mAgNO3 = n.M = 0,2.170 = 34(g);
– Phương trình phản ứng:
M + 2AgNO3 → M(NO3)2 + 2Ag
– Theo PTPƯ ta thấy, 2 mol AgNO3 tạo thành 1 mol M(NO3)2 thì khối lượng giảm là:
ΔM = (2.108 – M)(g) = (216 – M)(g)
Vậy: 0,2 mol AgNO3 → 0,1 mol M(NO3)2 thì khối lượng giảm là:
Δm = 34 – 18,8 = 15,2(g)
Suy ra: 0,2(216 – M) = 15,2.2 = 30,4
⇒ 0,2M = 12,8 ⇒ M = 64 ≡ Cu.
Vậy kim loại M là Cu.
* Bài tập 3: Cho 3,1 g hỗn hợp hai kim loại kiềm ở hai chu kì kế tiếp trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 (đktc). Xác định tên hai kim loại kiềm và tính thành phần % khối lượng mỗi kim loại trong hỗn hợp?
* Lời giải:
– Gọi 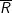 là ký hiệu và nguyên tử khối chung của 2 kim loại
là ký hiệu và nguyên tử khối chung của 2 kim loại
– Theo bài ra, ta có: 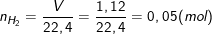
– Ta có, PTHH:
2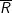 + 2H2O → 2
+ 2H2O → 2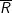 OH + H2↑
OH + H2↑
1mol 1mol 0,5(mol)
0,1(mol) 0,05(mol)
Theo PTHH trên ta có: 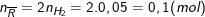
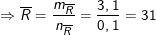
Theo bài ra, 2 kim loại kiềm ở 2 chu kì kết tiếp nên
⇒ 2 kim loại đó là Na (23) và K (39).
* Bài tập 4: Cho 8,8 gam một hỗn hợp gồm 2 kim loại ở hai chu kì liên tiếp thuộc nhóm IIA tác dụng với dung dịch HCl dư cho 6,72 lít khí hidro (đktc). Xác định hai kim loại?
* Lời giải:
– Đặt công thức chung của hai ki loại ở hai chu kì liên tiếp và thuộc phân nhóm IIA cần tìm là 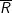 .
.
– Theo bài ra, ta có: 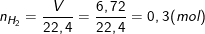
– Ta có PTHH:
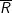 + 2HCl →
+ 2HCl → 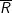 Cl2 + H2↑
Cl2 + H2↑
Theo PTHH thì: 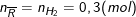
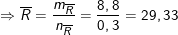
Trong nhóm IIA, có Mg = 24 < 29,33 < 40 = Ca;
Mg thuộc chu kì 2, Ca thuộc chu kì 3.
Vậy hai kim loại cần tìm là Mg và Ca.
* Bài tập 5: Hòa tan hoàn toàn 2,9 gam hỗn hợp kim loại M và oxit của nó vào nước, thu được 500ml dung dịch chứa một chất tan có nồng độ 0,04M và 0,224 lít khí H2 (đktc). Xác định M?
* Lời giải:
– Đổi đơn vị: 500ml = 0,5lít;
– Gọi a là số mol của kim loại là M
– Gọi b là số mol của M2On (với n là hóa trị của kim loại M).
– Phương trình phản ứng:
2M + 2nH2O → 2M(OH)n + nH2↑
a(mol) a (na)/2
M2On + nH2O → 2M(OH)n
b(mol) 2b
– Theo bài ra, và theo PTPƯ ta có:
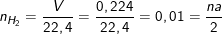
⇒ na = 0,02 (*)
Theo bài ra, và theo PTPƯ thì số mol chất tan M(OH)n là:
a + 2b = 0,5.0,04 = 0,02
⇒ na + 2nb = 0,02n (nhân 2 vế với n)
⇒ 2nb = 0,02n – na
⇒ 2nb = 0,02n – 0,02
⇒ nb = 0,01n – 0,01 (**)
Mặt khác, theo bài ra, ta có: Ma + (2M + 16n)b = 2,9
⇒ Ma + 2Mb + 16nb = 2,9 (***)
Thế (**) vào (***) ta được:
⇒ Ma + 2Mb + 16(0,01n – 0,01) = 2,9
⇒ Ma + 2Mb + 0,16n = 3,06
⇒ M(a + 2b) + 0,16n = 3,06
⇒ M.0,02 + 0,16n = 3,06
⇒ M + 8n = 153
– Lập bảng:
| n | 1 | 2 | 3 |
| M | 145 | 137 | 129 |
Ta thấy, chỉ có n = 2 thỏa, khi đó M = 137 ≡ Ba.
Kim loại là Bari (Ba).
Hy vọng với bài viết Cách giải Bài tập xác định tên Kim loại ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục