Bài tập về nhôm hidroxit là dạng thường gây nhầm lẫn cho nhiều bạn bởi tính lưỡng tính của nhôm hidroxit (vừa có thể tác dụng với axit lại vừa có thể tác dụng với bazơ).
Như vậy, bài tập về hidroxit lưỡng tính cũng có hai dạng phổ biến dưới đây, tùy thuộc vào tỉ lệ số mol của mỗi chất theo bài cho mà chúng ta có cách giải như sau:
This post: Các dạng bài tập về tính lưỡng tính của nhôm hidroxit Al(OH)3 và cách giải – Hóa 12 chuyên đề
I. Phương pháp giải các dạng bài tập về nhôm hidroxit lưỡng tính
Cho dung dịch OH– tác dụng với dung dịch Al3+ hoặc cho H+ tác dụng với dung dịch AlO–2 (hoặc [Al(OH)4]–
1. Cho từ từ a mol OH– vào dung dịch chứa b mol Al3+. Tìm khối lượng kết tủa:
– Phương trình ion thu gọn:
Al3+ + 3OH– → Al(OH)3↓ (1)
Al3+ + 4OH– → Al(OH)4– (2)
– Khi nhỏ từ từ dung dịch OH– vào dung dịch chứa Al3+ thì lượng kết tủa tăng dần đến cực đại sau đó giảm dần trở về dung dịch trong suốt.
– Sản phẩm tạo thành phụ thuộc vào tỉ lệ số mol Al3+ với số mol OH–.
Đặt 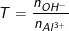
– Nếu T ≤ 3 thì chỉ xảy ra phản ứng (1), tức là phản ứng chỉ tạo kết tủa.
– Nếu 3 < T < 4 thì xảy ra cả hai phản ứng (1) và (2).
– Nếu T ≥ 4 thì chỉ xảy ra phản ứng (2), không có kết tủa tạo thành.
* Khi làm toán trắc nghiệm, ta có thể sử dụng công thức giải nhanh sau:
nOH–(min) = 3n↓
nOH–(max) = 4.nAl3+ – n↓
2. Nếu cho từ từ H+ vào dung dịch chứa AlO2– (hoặc [Al(OH)4]–) thì phản ứng xảy ra như sau:
H+ + Al(OH)4– → Al(OH)3↓ + H2O (1)
4H+ + Al(OH)4– → Al3+ + 4H2O (2)
– Như vậy lượng kết tủa tăng dần đến cực đại, sau đó giảm dần dung dịch trở thành trong suốt.
– Sản phẩm tạo thành phụ thuộc vào tỉ lệ số mol của H+ và tỉ lệ số mol Al(OH)4–
Đặt 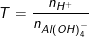
– Nếu T ≤ 1 chỉ xảy ra phản ứng (1); tức là phản ứng chỉ tạo kết tủa
– Nếu 1 < T < 4 thì xảy ra cả hai phản ứng (1) và (2).
– Nếu T ≥ 4 thì xảy ra phản ứng (2), phản ứng không có kết tủa tạo thành.
* Khi làm toán trắc nghiệm, ta có thể sử dụng công thức giải nhanh sau:
nOH–(min) = 3n↓ + nH+
nOH–(max) = 4.nAl3+ – n↓ + nH+
II. Bài tập vận dụng cách giải nhôm hidroxit Al(OH)3
* Bài tập 1: Rót 100 ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
> Lời giải:
Đổi đơn vị: 100ml = 0,1 lít;
– Theo bài ra, ta có: nNaOH = CM.V = 3,5.0,1 = 0,35 mol;
nAlCl3 = CM.V = 1.0,1 = 0,1 mol;
⇒ nOH– = 0,35 mol; nAl3+ = 0,1 mol;
Lập tỉ lệ mol: 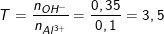
Vậy tạo hỗn hợp muối Al(OH)3: x mol và [Al(OH)4–: y mol
Theo bài ra, ta có hệ: 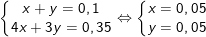
Vậy khối lượng chất kết tủa là: mAl(OH)3 = 0,05.78 = 3,9 g.
* Bài tập 2: Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X. Tính nồng độ mol/l các chất trong dung dịch X?
> Lời giải:
Đổi 450ml = 0,45 lít; 100ml = 0,1 lít;
– Theo bài ra, ta có: nKOH = CM.V = 2.0,45 = 0,9(mol) ⇒ nOH– = 0,9(mol);
nAl2(SO4)3 = CM.V = 1.0,1 = 0,1(mol) ⇒ nAl3+ = 2.0,1 = 0,2(mol);
Ta có: 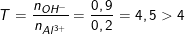
→ Tạo [Al(OH)4]– và OH– dư
Vậy dung dịch X có:
nAl(OH)4– = nAl3+ = 0,2(mol);
nOH–(dư) = 0,9 – 0,2.4 = 0,1(mol)
Vậy ta có: ![small C_{M(K[Al(OH)_4])}=frac{0,2}{0,45+0,1}approx 0,36M](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1642479608lxluc1jikk.gif)
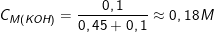
* Bài tập 3: Cho 500ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M. Sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa. Tính giá trị của V?
> Lời giải:
Đổi đơn vị: 500ml = 0,5 lít;
– Theo bài ra, ta có: nBa(OH)2 = CM.V = 0,1.0,5 = 0,05(mol);
Các phản ứng có thể xảy ra:
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓ (1)
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O (2)
• TH1: Chỉ xảy ra phản ứng (1)
mkết tủa = mBaSO4 + mAl(OH)3
= 0,05.223 + (2/3).0,05.78 = 14,25g > 12,045g (loại)
• TH2: Xảy ra cả 2 phản ứng Al(OH)3 bị hòa tan một phần
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓ (1)
x x 2x/3
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O (2)
0,05 – x 2(0,05 – x)
Vậy, ta có: mkết tủa = mBaSO4 + mAl(OH)3 (còn lại)
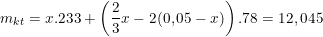
Suy ra: x = 0,045(mol)
Suy ra nAl2(SO4)3 = (1/3).nBa(OH)2 = 0,015(mol)
Suy ra: Vdd Al2(SO4)3 = n/CM = 0,015/0,1 = 0,15(l)
Hy vọng với bài viết Các dạng bài tập về tính lưỡng tính của nhôm hidroxit Al(OH)3 và cách giải ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để Mầm Non Ánh Dươngghi nhận và hỗ trợ, chúc các em học tốt!
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục