Tương tự như Nhôm Al, các bài tập về sắt và các hỗn hợp hay hợp chất của Sắt Fe cũng có nhiều bài tập gây bối rối cho các em học sinh, hơn nữa đây lại là nội dung thường có trong đề thi THPT quốc gia.
Vậy chúng ta phải dùng phương pháp nào để giải các bài tập về Sắt, các hỗn hợp hay hợp chất của Sắt để đảm bảo chính xác và nhanh gọn? Bài viết này sẽ sơ lược lại một số tính chất hóa học của sắt và các hợp chất của sắt, đồng thời cũng sẽ là câu trả lời cho thắc mắc trên.
This post: Phương pháp giải các dạng bài tập về Sắt Fe, hỗn hợp và hợp chất của Sắt – hóa lớp 12
I. Kiến thức cần nhớ về Sắt Fe
* Tính chất hóa học của Sắt Fe
♦ Tác dụng với phi kim
♦ Tác dụng với nước
♦ Tác dụng với dung dịch Axit
♦ Tác dụng với dung dịch Muối
– Về chi tiết các phản ứng hóa học của Sắt Fe với các chất và dung dịch ở trên nếu chưa nhớ, các em có thể xem lại bài viết: Tính chất hóa học của Sắt Fe và Tính chất hóa học các hợp chất của Sắt
– Trong bài viết này tập trung vào các dạng toán về sắt, hỗn hợp của sắt và phương pháp giải nên tác giả chỉ nhắc lại một số tính chất hóa học quan trọng của Sắt.
* Một số phản ứng quan trọng của Sắt:
Fe + 2Fe3+ → 3Fe2+
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe2+ + Ag+ → Fe3+ + Ag
Fe(NO3)2 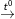 Fe2O3 + NO2 + O2
Fe2O3 + NO2 + O2
4Fe(OH)2 + O2 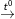 2Fe2O3 + 4H2O (Không có không khí thì ra FeO)
2Fe2O3 + 4H2O (Không có không khí thì ra FeO)
2FeCO3 + ½O2 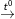 Fe2O3 + 2CO2
Fe2O3 + 2CO2
II. Một số lưu ý khi giải các bài tập về Sắt, hỗn hợp của Sắt
– Khi giải các bài toán về Sắt, hỗn hợp và hợp chất của sắt cần vận dụng linh hoạt các định luật bảo toàn khối lượng, định luật bảo toàn electron, định luật bảo toàn nguyên tố,…
1. Để giải các bài toán về sắt và hỗn hợp sắt thường áp dụng các định luật sau
+ Định luật bảo toàn khối lượng: Khối lượng của các chất tham gia phản ứng bằng khối lượng các chất tạo thành sau phản ứng. Nghĩa là: Tổng khối lượng các chất trước phản ứng (mT) = Tổng khối lượng của các chất sau phản ứng (mS): mT = mS
+ Định luật bảo toàn nguyên tố: Trong các phản ứng, quá trình hóa học các nguyên tố luôn được bảo toàn. Nghĩa là:
◊ Tổng số mol nguyên tử của nguyên tố M bất kỳ trước và sau phản ứng không đổi.
◊ Khối lượng nguyên tử của nguyên tốt M bất kỳ trước và sau phản ứng không đổi.
+ Định luật bảo toàn electron: Nguyên tắc cân bằng phản ứng oxi hóa – khử theo phương pháp thăng bằng electron, tổng số electron nhường = tổng số electron nhận. Từ đó suy ra, Tổng số mol electron nhường = Tổng số mol electron nhận trong 1 phản ứng hay 1 hệ phản ứng.
∑a.nM = ∑ne nhường = ∑ne nhận = ∑b.nX
(trong đó a là số electron M nhường, b là số electron X nhận).
– Nếu hỗn hợp cho FeO , Fe2O3 , Fe3O4 ta có thể quy đổi về hỗn hợp FeO , Fe2O3 hoặc chỉ còn Fe3O4 nếu số mol của chúng bằng nhau.
– Dưới đây là một số ví dụ giải bài toán dựa theo PTPƯ và vận dụng các định luật bảo toàn:
Ví dụ 1: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X là bao nhiêu?
* Lời giải:
– Sơ đồ bài toán: m gam X (Fe, FeS) –qua HCl dư→ Y (FeCl2, HCl dư) + 4,982 lít khí Z (H2, H2S) –qua Pb(NO3)2→ 47,8g PbS↓
• Cách 1: Phương pháp giải theo PTPƯ
– Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X
– Ta có phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2↑
x mol x mol
FeS + 2HCl → FeCl2 + H2S
y mol y mol
H2S + Pb(NO3)2 → FeS + HNO3
y mol y mol
– Ta có: 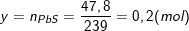 ;
; 
⇒ x = 0,02(mol).
⇒ %mFeS 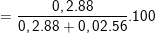 ≈94,02%
≈94,02%
• Cách 2: Áp dụng định luật bảo toàn
– Theo định luật bảo toàn nguyên tố S, ta có: nFeS = nH2S = nPbS = 47,8/239 = 0,2(mol).
– Ta có: nZ = nH2 + nH2S = 4 ,982/22,4 = 0,22(mol).
⇒ nH2 = 0,22 – 0,2 = 0,002 (mol).
– Theo định luật bảo toàn electron (số electron nhường = số electron nhận) thì: nFe = nH2 = 0,02(mol).
⇒ %mFeS 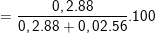 ≈94,02%
≈94,02%
Ví dụ 2: Nung 5,6 gam bột sắtt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lit dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Tính giá trị của m?
* Lời giải:
– Sơ đồ bài toán: (5,6 gam Fe và 13 gam Zn) + S → Rắn X (FeS, ZnS, S dư) + HCl → Khí Y (H2S) + CuSO4 → m gam CuS
• Cách 1: Phương pháp giải theo PTPƯ
– Ta có: nFe = 5,6/56 = 0,1(mol); nZn = 13/65 = 0,2(mol);
Fe + S → FeS
Zn + S → ZnS
FeS + HCl → FeCl2 + H2S
ZnS + HCl → ZnCl2 + H2S
H2S + CuSO4 → CuS + H2SO4
– Theo PTPƯ ta có: nCuS = nH2S = nFeS + nZnS = nFe + nZn = 0,1 + 0,2 = 0,3(mol).
⇒ mCuS = 0,3.96 = 28,8(g).
• Cách 2: Áp dụng định luật bảo toàn
– Theo định luật bảo toàn electron thì: số e nhường = số e nhận
– Mà Fe nhường 2e ; Zn nhường 2e ; còn S nhận 2e nên ta có: 2nFe + 2nZn = 2nS
⇒ nS = nFe + nZn = 0,1 + 0,2 = 0,3(mol).
– Theo định luật bảo toàn nguyên tố ta có: nCuS = nS = 0,3(mol) ⇒ mCuS = 0,3.96 = 28,8(g).
* Như vậy ta thấy việc áp dụng các định luật bảo toàn giúp chúng ta giải bài toán nhanh hơn, gọn và chính xác ⇒ đặc biệt thuận lợi đối với các bài toán trắc nghiệm.
2. Phương pháp giải bài tập về sắt, hỗn hợp sắt khi tác dụng với axit
– Với các dạng bài toán về sắt, hỗn hợp sắt (các oxit sắt FeO, Fe2O3, Fe3O4) phổ biến là cho hỗn hợp này tác dụng với các axit như HNO3 hay H2SO4 vì vậy các em cần lưu ý thêm các vấn về sau:
a) Với axit nitric HNO3
– Sản phẩm khử khi Nitơ nhận electron (tạo các sản phẩm NO2, NO, , N2, NH4NO3) theo bảng sau.
| axit | số electron N nhận | sản phẩm khử |
| HNO3 | +1e | NO2 |
| +3e | NO | |
| +8e | N2O | |
| +8e | NH4NO3 | |
| +10e | N2 |
– Từ bảng trên, theo định luật bảo toàn e, ta có:
∑ne (nhận) 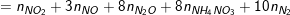
– Theo định luật bảo toàn nguyên tố (nitơ), ta có:
nHNO3 (pư) = nNO3– (tạo muối kim loại) + nNO2 + nNO + 2nN2O + 2nNH4NO3 + 2nN2
– Ta có: nNO3– (tạo muối kim loại) = ∑ne (nhường) = ∑ne (nhận)
– Khối lượng muối: mmuối = mkim loại + mNO3– (tạo muối)
* Chú ý: Sản phẩm khử nào không có (trong PTPƯ) thì số mol bằng 0.
b) Với axit sunfuric H2SO4 đặc nóng
– Sản phẩm khử khi lưu huỳnh S nhận electron (tạo các sản phẩm SO2, S, , H2S) theo bảng sau.
| axit | số electron S nhận | sản phẩm khử |
| H2SO4 | +2e | SO2 |
| +6e | S | |
| +8e | H2S |
– Từ bảng trên, theo định luật bảo toàn e, ta có:
∑ne (nhận) = 2nSO2 + 6nS + 8nH2S
– Theo định luật bảo toàn nguyên tố (lưu huỳnh S), ta có:
nH2SO4 (pư) = nSO42– (tạo muối kim loại) + nSO2 + nS + nH2S
– Ta có: nSO42– (tạo muối kim loại) = ½∑ne (nhường) = ½∑ne (nhận)
– Khối lượng muối: mmuối = mkim loại + mSO42- (tạo muối)
* Chú ý: Sản phẩm khử nào không có (trong PTPƯ) thì số mol bằng 0.
III. Một số dạng bài tập về Sắt, hỗn hợp của sắt và phương pháp giải
Dạng 1: Sắt và hợp chất của Sắt tác dụng với axit.
* Lưu ý dãy điện hóa của kim loại:

– Nếu sau quá trình phản ứng xảy ra hoàn toàn, nếu dư kim loại Fe thì:
Fe + 2Fe3+ → 3Fe2+
Ví dụ 1: Nung 25,2g sắt trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, FeO, Fe2O3, Fe3O4. Hòa tan m gam hỗn hợp X vào dung dịch HNO3 dư thu được 6,76 lít khí NO2 là sản phẩm khử duy nhất. Tính m?
* Hướng dẫn giải:
– Áp dụng định luật bảo toàn khối lượng: m = mFe + mO (pư)
– Trong quá trình PƯ: Fe nhường e còn N (nhận 1e từ N+5 thành N+4) và O (nhận 2e) nhận e
– Áp dụng định luật bảo toàn e, ta có: 3nFe = 2nO (pư) + nNO2
* Lời giải chi tiết:
– Theo bài ra, ta có: 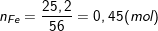
Số mol khí NO2 thu được: 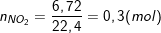
– Theo định luật bảo toàn e ta có: 3nFe = 2nO(pư) + nNO2
⇒ nO (pư) = ½(3nFe – nNO2) = ½(3.0,45 – 0,3) = 0,525 (mol).
⇒ mO (pư) = 0,525.16 = 8,4(g).
– Theo định luật bảo toàn khối lượng, ta có: m = mFe + mO(pư)
⇒ m = 25,2 + 8,4 = 33,6 (g).
Ví dụ 2: Hòa tan hoàn tòa 49,6g hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 bằng dung dịch H2SO4 đặc nóng thu được dung dich Y và 8,96 lít khí SO2 (ĐKTC). Tính khối lượng muối trong dung dịch Y.
* Hướng dẫn giải:
– ĐL bảo toàn khối lượng: mX = mFe + mO
– Trong quá trình PƯ: Fe nhường e còn O (nhận 2e) và S (nhận 2e từ S+6 thành S+4 trong SO2)
– ĐL bảo toàn e: 3nFe = 2nO + 2nSO2
– mmuối = mFe2(SO4)3 = ½(nFe).400
* Lời giải chi tiết:
– Theo bài ra ta có số mol SO2 là: 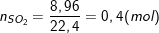
– Gọi số mol Fe và O trong hỗn hợp lần lượt là x và y (mol), ta có:
56x + 16y = 49,6 (*)
– Theo định luật bảo toàn e, ta có: 3nFe = 2nO + 2nSO2
⇒ 3x = 2y + 2.0,4 ⇒ 3x – 2y = 0,8 (**)
– Từ (*) và (**) giải hệ ta được: x = 0,7 và y =0,65 (mol)
– Khối lượng muối trong dung dịch Y: mmuối = mFe2(SO4)3 = ½(nFe).400 = (½).0,7.400 = 140(g).
Ví dụ 3: Cho 10,4 gam hỗn hợp X gồm Fe, S, FeS, FeS2 tác dụng với dung dịch HNO3 đặc nóng dư thu được V lít khí NO2 (là sản phẩm khử duy nhất đo ở ĐKTC) và dung dịch A. Cho A tác dụng với dung dịch Ba(OH)2 dư thu được 45,65g kết tủa. Tìm giá trị của V?
* Hướng dẫn giải:
– Theo định luật bảo toàn khối lượng thì: mhh = mFe + mS = 10,4(g).
– Quá trình PƯ: ![small left{egin{matrix} Fe:x(mol) S:y(mol) end{matrix}
ight.xrightarrow[]{+HNO_{3}}left{egin{matrix} Fe^{3+}: x(mol) SO_{4}^{2-}:y(mol) end{matrix}
ight.](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1553403707og7rm13reu-1.gif)
![small xrightarrow[]{+Ba(OH)_{2}}left{egin{matrix} Fe(OH)_{3}:x (mol) BaSO_{4}:y(mol) end{matrix}
ight.](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1553403708dju6cyeiza-1.gif)
Trong quá trình này: Fe nhường 3e và S nhường 6e, N nhận 1e
– Theo định luật bảo toàn e, ta có: 3nFe + 6nS = nNO2
* Lời giải chi tiết:
– Theo bài ta, 10,4 gam hỗn hợp, ta có: mhh = 56x + 32y = 10,4 (*)
– Thu được 45,65 gam kết tủa là Fe(OH)3 và BaSO4 , ta có: 107x + 233y = 45,65 (**)
– Giải hệ (*) và (**) ta được: x = 0,1 và y = 0,15(mol).
– Theo định luật bảo toàn e, thì ta có: 3nFe + 6nS = nNO2 ⇒ nNO2 = 3.0,1+6.0,15 = 1,2(mol).
⇒ V = 1,2.22,4 = 26,88(lít).
Dạng 2: Bài tập về sắt, đồng và hợp chất tác dụng với axit
– Đối với dạng bài tập này chúng ta cũng cần quan tâm đến dãy điện hóa của kim loại ở trên và quy tắc alpha ∝. Trường hợp bài toán có Fe và Cu hoặc 1 trong 2 kim loại này tác dụng với axit có tính oxi hóa (axit thiếu) hoặc sau phản ứng hoàn toàn vẫn còn kim loại dư.
– Nếu sau phản ứng còn kim loại thì muối thu được không có muối của ion Fe3+ vì:
Fe + Fe3+ → Fe2+
hoặc: Cu + 2Fe3+ → Cu2+ + 2Fe2+
Ví dụ 1: Hòa tan hoàn toàn 12g hỗn hợp Fe và Cu bằng axit HNO3 thu được 5,6 lít (ĐKTC) hỗn hợp khí X gồm NO và NO2 và dung dịch Y (chỉ chứa muối và axit dư). Tỉ khối của X so với H2 bằng 19. Cô cạn Y thu được m gam muối khan, tính m?
* Hướng dẫn giải:
– Đầu tiên tìm số mol NO và NO2
– Trong quá trình (quá trình pư): Fe và Cu nhường e, N nhận e (N+5 nhận 1e thành N+4 trong NO2; N+5 nhận 3e thành N+2 trong NO)
– Khối lượng muối: mmuối = mkim loại + mNO3– (tạo muối)
* Lời giải chi tiết:
– Gọi x và y lần lượt là số mol của NO và NO2
– Theo bài ra, thu được 5,6 lít hỗn hợp khí NO và NO2 (ĐKTC) nên ta có:
 (*)
(*)
– Tỉ khối của 2 khí so với hidro bằng 19 nên ta có: 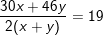
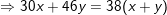
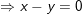 (**)
(**)
– Giải hệ (*) và (**) ta được x=y=0,125(mol).
⇒ ∑enhận = 3nNO + nNO2 = 3.0,125 + 0,125 = 0,5(mol).
⇒ nNO3– (tạo muối kim loại) = ∑ne (nhận) = 0,5(mol) ⇒ mNO3– (tạo muối kim loại) = 0,5.62 = 31(g).
⇒ mmuối = mkim loại + nNO3– (tạo muối kim loại) = 12 + 31 = 43(g).
Ví dụ 2: Đem nung nóng hỗn hợp A gồm 2 kim loại: x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2g hỗn hợp B gồm 2 kim loại trên và hỗn hợp oxit của chúng. Đem hòa tan hết lượng hỗn hợp B bằng dung dịch H2SO4 đặc nóng dư thì thu được 0,3 mol SO2. Tính x?
* Hướng dẫn giải:
– Trong quá trình thì Cu nhường 2e , Fe nhường 3e còn S (nhận 2e từ S6+ thành S4+) O nhận 2e
– Theo ĐLBT e thì: 3nFe + 2nCu = 2nSO2 + 2nO
– Tìm mO theo định luật BTKL: mO = mB – (mFe + mCu) = 63,2 – (56x + 0,15.64)
* Lời giải chi tiết:
– Theo bài ra: x mol Fe, 0,15 mol Cu nên ta có: mFe = 56x; mCu = 0,15.64 = 9,6(g).
– Theo định luật bảo toàn e thì: 3nFe + 2nCu = 2nSO2 + 2nO
⇔ 3x + 2.0,15 = 2.0,3 + 2.nO ⇒ nO = 1,5x – 0,15 ⇒ mO = 16(1,5x-0,15) = 24x-2,4 (*)
– Theo định luật BTKL ta có: mO = mB – (mFe + mCu) = 63,2 – (56x + 0,15.64) (**)
– Từ (*) và (**) ⇒ 24x-2,4 = 63,2 – (56x + 0,15.64) ⇒ 80x = 56 ⇒ x = 0,7 (mol)
Ví dụ 3: Hoà tan hoàn toàn 2,44g hỗn hợp bột X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng (dư). Sau phản ứng thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất đo ở ĐKTC) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Tính % khối lượng của Cu trong X.
* Hướng dẫn giải:
– Gọi a, b, c là số mol của Fe, Cu và O trong hỗn hợp: 56a + 64b + 16c = 2,44
– Trong quá trình pư thì: Fe nhường 3e, Cu nhường 2e, S nhận 2e và O nhận 2e
– Theo định luật bảo toàn e ta có: 3nFe + 2nCu = 2nO + 2nSO2 ⇔ 3a + 2b = 2c + 2nSO2
– Muối thu được: nFe2(SO4)3 = (½).a (mol). nCuSO4 = b(mol).
* Lời giải chi tiết:
– Theo bài ra thu được 0,504 lít khí SO2, ta có: nSO2 = 0,504/22,4 = 0,0225(mol).
– Gọi a, b, c là số mol của Fe, Cu và O trong hỗn hợp: 56a + 64b + 16c = 2,44 (*)
– Trong quá trình pư thì: Fe nhường 3e, Cu nhường 2e, S nhận 2e và O nhận 2e
– Theo định luật bảo toàn e ta có: 3nFe + 2nCu = 2nO + 2nSO2
⇔ 3a + 2b = 2c + 2nSO2 ⇔ 3a + 2b – 2c = 0,045 (**)
– nFe2(SO4)3 = (½).nFe = (½).a ; nCuSO4 = nCu = b(mol).
– Theo bài ra: mhh muối = mFe2(SO4)3 + mCuSO4 = 6,6(g).
⇒ 400.(½)a +160b = 6,6 ⇔ 200a +160b = 6,6 (***)
– Giải hệ gồm các pt (*), (**) và (***) ta có: a=0,025; b=0,01; c=0,025;
⇒ mCu = 64.0,01 = 0,64(g)
⇒ %mCu = (0,64/2,44).100% ≈ 26,23%
Ví dụ 4: Cho 16,6g hỗn hợp X gồm Fe, Cu tác dụng với Oxi thu được m gam hỗn hợp chất rắn Y. Cho toàn bộ Y tác dụng hết với H2SO4 đặc nóng thu được dung dịch Z có chưa 3 muối, tổng lượng muối là 43,96g và 2,8 lít khí SO2 duy nhất ở (ĐKTC). Tính m?
* Hướng dẫn giải:
– Để tính m, cần tính mO trước vì: m = mx + mO
– Theo bài ra các muối là: Fe2(SO4)3, FeSO4 và CuSO4
– Trong quá trình: Fe, Cu nhường e, còn O, S nhận e
* Lời giải chi tiết:
– Theo bài ra, nSO2 = 2,8/22,4 = 0,125(mol).
– Theo ĐTBTKL thì: mmuối = mkim loại + mSO42- (tạo muối) ⇒ mSO42- (tạo muối) = mmuối – mkim loại
⇒ mSO42- (tạo muối) = 43,96 – 16,6 = 27,36(g). ⇒ nSO42- (tạo muối) = 27,36/96 = 0,285(mol).
– Theo bài ra, ta có: ∑ne nhận = 2nO + 2nSO2 (*)
– Ta lại có: 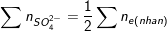 =(1/2)(2nO + 2nSO2) = nO + nSO2 = 0,285
=(1/2)(2nO + 2nSO2) = nO + nSO2 = 0,285
⇒ nO + 0,125 = 0,285 ⇒ nO = 0,16(mol) ⇒ mO = 0,16.16 = 2,56(g).
⇒ m = mx + mO = 16,6 + 2,56 = 19,16(g).
* Bài tập về Sắt và hợp chất của Sắt các em tự giải
Bài tập 1: Nung x mol Fe trong không khí một thời gian thu được 16,08 gam hỗn hợp H gồm 4 chất rắn gồm Fe và 3 oxit của nó. Hòa tan hết lượng hỗn hợp H trên bằng dung dịch HNO3 loãng, thu được 672 ml khí NO duy nhất (đktc). Tính x?
Đ/S: 0,21(mol).
Bài tập 2: Để m gam bột sắt ngoài không khí một thời gian, thu được 2,792 gam hỗn hợp A gồm sắt kim loại và các oxit. Hòa tan tan hết hỗn hợp A bằng dung dịch HNO3 loãng, dư thu được một muối duy nhất và có 380,8 ml khí NO duy nhất thoát ra (đktc). Trị số của m là
Đ/S: 2,24(g).
Bài tập 3: Hòa tan hoàn toàn hỗn hợp 0,12 mol FeS2 và a mol CuS2 vào axit HNO3 vừa đủ, thu được dung dịch X chỉ chứa 2 muối sunfat và khí duy nhất là NO. Tính a?
Đ/S: 0,04 (mol).
Bài tập 4: Cho 11,36g hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất ở đktc) và dung dịch X, cô cạn X thu được m gam muối khan. Tính m?
Đ/S: 38,72(g).
Bài tập 5: Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Cô cạn đung dịch X, thu được m gam muôi sunfat khan. Tính giá trị của m?
Đ/S: 58,0(g).
Bài tập 6: Cho m gam Fe vào bình chứa dung dịch gồm H2SO4 và HNO3 , thu được dung dịch X và 1,12 lít khí NO. Thêm tiếp dung dịch H2SO4 dư vào bình thu được 0,448 lít khí NO và dung dịch Y. Biết trong cả hai trường hợp NO là sản phẩn khử duy nhất, đo ở điều kiện tiêu chuấn. Dung dịch Y hòa tan vừa hết 2,08 gam Cu (không tạo thành sản phẩm khử của N+5). Biết các phản ứng đều xảy ra hoàn toàn. Tính m?
Đ/S: 4,06(g).
• xem thêm: Phương pháp giải các dạng bài tập về nhôm và hợp chất của nhôm
Như vậy, nội dung chủ yếu ở bài viết này tập trung vào một dạng bài tập tương đối ‘khó nhằn’ với nhiều bạn khi học hóa, đó là dạng về sắt, hợp chất của sắt tác dụng với axit. Ngoài ra còn một số dạng bài tập khác về sắt cũng sẽ sớm được HayHocHoi.Vn gửi tới các bạn.
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hóa học của sắt, phương pháp giải các dạng bài tập về sắt, hỗn hợp và hợp chất của sắt ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục