Hóa 12 bài 19: Hợp kim là gì? Tính chất, Cấu tạo của Hợp kim và Ứng dụng. Ở bài học trước các em đã tìm hiểu về tính chất của kim loại và dãy điện hóa của kiêm loại, trong bài này chúng ta sẽ tìm hiểu về hợp kim.
Vậy hợp kim là gì? hợp kim có tính chất gì và được cấu tạo như thế nào? Hợp kim có ứng dụng gì trong đời sống thực tế?
This post: Hóa 12 bài 19: Hợp kim là gì? Tính chất, Cấu tạo của Hợp kim và Ứng dụng
I. Khái niệm hợp kim
– Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác.
* Ví dụ: Thép là hợp kim của Fe với C và một số nguyên tố khác; Đuyra là hợp kim của Al với Cu, Mn, Mg, Si.
II. Tính chất của hợp kim
– Tính chất của hợp kim phụ thuộc vào thành phần các đơn chất tham gia cấu tạo mạng tinh thể của hợp kim.
* Ví dụ một số hợp kim như:
Hợp kim không bị ăn mòn: Fe – Cr – Ni (thép inoc),…
Hợp kim siêu cứng: W – Co, Co – Cr – W – Fe,…
Hợp kim có nhiệt độ nóng chảy thấp: Sn – Pb (thiếc hàn), t0nc = 2100C; Bi – Pb – Sn, t0nc = 650C,
Hợp kim nhẹ, cứng và bền: Al – Si, Al – Cu – Mn – Mg.
III. Ứng dụng của hợp kim
– Những hợp kim nhẹ, bền chịu được nhiệt độ cao và áp suất cao dùng để chế tạo tên lửa, tàu vũ trụ, máy bay, ô tô,…
– Những hợp kim có tính bền hoá học và cơ học cao dùng để chế tạo các thiết bị trong ngành dầu mỏ và công nghiệp hoá chất.
– Những hợp kim không gỉ dùng để chế tạo các dụng cụ y tế, dụng cụ làm bếp,…
– Hợp kim của vàng với Ag, Cu (vàng tây) đẹp và cứng dùng để chế tạo đồ trang sức và trước đây ở một số nước còn dùng để đúc tiền.
IV. Bài tập về Hợp kim
* Bài 1 trang 91 SGK Hóa 12: Những tính chất vật lí chung của kim loại tinh khiết biến đổi thế nào khi biến thành hợp kim?
° Lời giải bài 1 trang 91 SGK Hóa 12:
+ Hợp kim dẫn điện và nhiệt kém hơn kim loại nguyên chất.
– Độ cứng của hợp kim hơn hơn độ cứng của kim loại nguyên chất, độ dẻo thì hợp kim kém hơn kim loại.
– Nhiệt độ nóng chảy của hợp kim thấp hơn nhiệt độ nóng chảy của kim loại thành phần.
* Bài 2 trang 91 SGK Hóa 12: Để xác định hàm lượng của bạc trong hợp kim người ta hòa tan 0,5 gam hợp kim đó vào dung dịch axit nitric. Cho thêm dung dịch axit clohidric vào dung dịch trên thu được 0,398 gam kết tủa. Tính hàm lượng bạc trong hợp kim.
° Lời giải bài 2 trang 91 SGK Hóa 12:
– Ta có PTPƯ:
Ag + 2HNO3 → AgNO3 + NO2↑ + H2O (1)
AgNO3 + HCl → AgCl↓trắng + HNO3 (2)
– Số mol AgCl kết tủa là: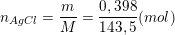
– Theo PTPƯ (2) ta có: nAgNO3 = nAgCl = 0,398/143,5(mol)
– Theo PTPƯ (1), ta có: nAg = nAgNO3 = 0,398/143,5(mol)
⇒ Khối lượng của Ag là: mAg = n.M = [0,398/143,5].108 ≈ 0,3(g).
⇒ Hàm lượng của bạc trong hợp kim là:
%mAg= [mAg/mhợp kim].100% = (0,3/0,5).100% = 60%.
* Bài 3 trang 91 SGK Hóa 12: Trong hợp kim Al – Ni cứ 10 mol Al thì có 1 mol Ni. Phần trăm khối lượng của hợp kim này là phương án nào sau đây.
A. 81% Al và 19% Ni.
B. 82% Al và 18% Ni.
C. 83% Al và 17% Ni.
D. 84% Al và 16% Ni.
° Lời giải bài 3 trang 91 SGK Hóa 12:
• Chọn đáp án: B. 82% Al và 18% Ni.
– Khối lượng Al là mAl = 27.10 = 270 (g)
– Khối lượng Ni là mNi= 59.1 = 59 (g)
– Khối lượng hỗn hợp: mhh = mAl + mNi = 270 + 59 = 329 (g)
⇒ Thành phần % theo khối lượng:
%mAl = [270/329].100% ≈ 82%
%mNi = [59/329].100% ≈ 18%
* Bài 4 trang 91 SGK Hóa 12: Ngâm 2,33 gam hợp kim Fe – Zn trong dung dịch HCl đến phản ứng hoàn toàn thấy giải phóng 896 ml khí H2(đktc). Thành phần % của hỗn hợp là phương án nào sau đây.
A. 27,9% Zn và 72,1% Fe.
B. 26,9% Zn và 73,1% Fe.
C. 25,9% Zn và 74,1% Fe.
D. 24,9% Zn và 75,1% Fe.
° Lời giải bài 4 trang 91 SGK Hóa 12:
• Chọn đáp án: A. 27,9% Zn và 72,1% Fe.
– Phương trình phản ứng
Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
– Gọi x, y lần lượt là số mol Fe và Zn trong hỗn hợp thì theo bài ra ta có:
56x + 65y = 2,33 (1)
– Số mol H2 là nH2 = [896/(1000.22,4)] = 0,04(mol)l; nên theo phương trình phản ứng, ta có:
x + y = 0,04 (2)
– Từ (1) và (2) ta có: x = 0,03; y = 0,01.
– Khối lượng của Fe và Zn có trong hỗn hợp là:
mFe = 0,03.56 = 1,68(g)
mZn = 0,01.65 = 0,65(g)
– Thành phần % theo khối lượng hỗn hợp là :
%mFe = [mFe/mhh].100% = (1,68/2,33).100% = 72,1%
%mZn = [mZn/mhh].100% = (0,65/2,33).100% = 27,9%.
Hy vọng với bài viết về Hợp kim là gì? Tính chất, Cấu tạo của Hợp kim và Ứng dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





