Hóa 11 bài 41: Tính chất hóa học và công thức cấu tạo của Phenol C6h5OH. Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C của vòng benzen và được ứng dụng trong một số lĩnh vực của đời sống sản xuất.
Vậy phenol có tính chất hóa học, tính chất vật lý gì? công thức cấu tạo và công thức phân tử như thế nào mà có thể được ứng dụng trong công nghiệp chất dẻo, thuốc sát trùng,… chúng ta hãy cùng tìm hiểu qua bài viết dưới đây.
This post: Hóa 11 bài 41: Tính chất hóa học và công thức cấu tạo của Phenol C6h5OH
I. Định nghĩa và phân loại Phenol
1. Phenol là gì?
– Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C của vòng benzen.
* Lưu ý: Phân biệt giữa phenol và ancol thơm (phenol có nhóm OH liên kết trực tiếp với C của vòng benzen, ancol có nhóm OH liên kết với C của nhánh).
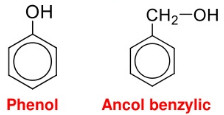
Công thức cấu tạo của phenol và của ancol benzylic
2. Phân loại phenol
– Những phenol mà phân tử có chứa 1 nhóm –OH thì phenol thuộc loại monophenol. Ví dụ: phenol, o-crezol, m-crezol, p-crezol,…
– Những phenol mà phân tử có chứa nhiều nhóm –OH thì phenol thuộc loại poliphenol.
* Nhận xét: Phenol cũng là tên riêng của hợp chất cấu tạo bởi nhóm phenyl liên kết với nhóm hiđroxyl (C6H5-OH), chất tiêu biểu cho các phenol.
II. Tính chất vật lý của Phenol
– Phenol ít tan trong nước lạnh, tan nhiều trong nước nóng nên dùng để tách bằng phương pháp chiết.
– Là chất rắn, độc, khi để lâu trong không khí bị chảy rữa do hút ẩm và chuyển thành màu hồng.
III. Tính chất hóa học của Phenol
1. Cấu tạo của phân tử phenol
– Phân tử phenol cấu tạo gồm 2 phần: Gốc phenyl (-C6H5) và nhóm chức hydroxyl (-OH).
– Gốc C6H5 hút e làm cho liên kết O-H trong phân tử phenol phân cực hơn liên kết O-H của ancol. Vì vậy, H trong nhóm OH của phenol linh động hơn H trong nhóm OH của ancol và biểu hiện được tính axit yếu (phenol có tên gọi khác là axit phenic).
– Do có hiệu ứng liên hợp nên cặp e chưa sử dụng của nguyên tử O bị hút về phía vòng benzen làm cho mật độ e của vòng benzen đặc biệt là các vị trí o-, p- tăng lên nên phản ứng thế vào vòng benzen của phenol dễ hơn và ưu tiên vào vị trí o-, p- .
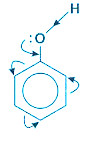
2. Tính chất hóa học của Phenol
a) Tính chất của nhóm OH
– Phenol tác dụng với kim loại kiềm (Phenol + Na):
C6H5OH + Na → C6H5ONa + 1/2H2
→ Phản ứng này dùng để phân biệt phenol với anilin.
– Phenol tác dụng với dung dịch kiềm (phenol + NaOH):
C6H5OH + NaOH → C6H5ONa + H2O
– Ancol không có phản ứng này chứng tỏ H của phenol linh động hơn H của Ancol và chứng minh ảnh hưởng của gốc phenyl đến nhóm OH. Phenol thể hiện tính axit nhưng là axit rất yếu không làm đổi màu quỳ tím, yếu hơn cả axit cacbonic.
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
→ Phản ứng này dùng để tách phenol khỏi hỗn hợp anilin và phenol sau đó thu hồi lại phenol nhờ phản ứng với các axit mạnh hơn (Phenol + HCl):
C6H5ONa + HCl → C6H5OH + NaCl
– Phenol bị CO2 đẩy ra khỏi muối → phenol có tính axit yếu hơn axit cacbonic → phenol không làm đổi màu quỳ tím. (dùng axit mạnh đẩy axit yếu ra khỏi muối để chứng minh trật tự tính axit của các chất). Phản ứng này cũng chứng minh được ion C6H5O– có tính bazơ.
b) Phản ứng thế vào vòng benzen
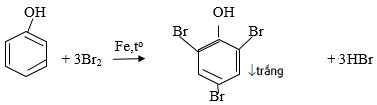
– Thế Brom: phenol tác dụng với dung dịch brom tạo 2,4,6 – tribromphenol kết tủa trắng (phenol+Br2):
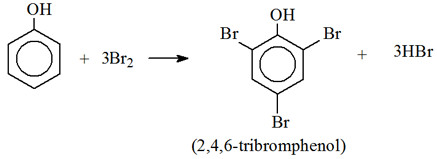
→ Phản ứng này dùng để nhận biết phenol khi không có mặt của anilin và chứng minh ảnh hưởng của nhóm OH đến khả năng phản ứng của vòng benzen.
– Thế Nitro: phenol tác dụng với HNO3 đặc có xúc tác H2SO4 đặc, đun nóng tạo 2,4,6 – trinitrophenol (axit picric):
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Chú ý: Ngoài phenol, tất cả những chất thuộc loại phenol mà còn nguyên tử H ở vị trí o, p so với nhóm OH đều có thể tham gia vào 2 phản ứng thế brom và thế nitro.
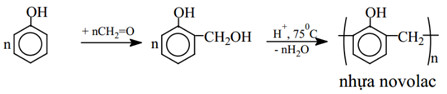
c) Phản ứng tạo nhựa phenolfomanđehit
– Phenol + HCHO trong môi trường axit tạo sản phẩm là nhựa phenolfomandehit.
nC6H5OH + nHCHO → nH2O + (HOC6H2CH2)n
– Chuỗi phản ứng tạo nhựa novolac
IV. Điều chế Phenol
1. Điều chế phenol từ benzen
C6H6 → C6H5Cl → C6H5ONa → C6H5OH
C6H6 → C6H5CH(CH3)2 → C6H5OH
2. Điều chế phenol bằng phương pháp chưng cất nhựa than đá
– Nhựa than đá + NaOH dư.
– Chiết để lấy lớp nước có C6H5ONa.
– C6H5ONa + HCl → C6H5OH + NaCl
V. Ứng dụng của phenol
+ Phenol được dùng trong nhiều lĩnh vực khác nhau:
– Công nghiệp chất dẻo: phenol là nguyên liệu để điều chế nhựa phenol formaldehyde.
– Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
– Nông dược: Từ phenol điều chế được chất diệt cỏ dại và kích thích tố thực vật 2,4 – D (là muối natri của axit 2,4 điclophenoxiaxetic).
– Phenol cũng là nguyên liệu để điều chế một số phẩm nhuộm, thuốc nổ (axit picric).
– Do có tính diệt khuẩn nên phenol được dùng để trực tiếp làm chất sát trùng, tẩy uế, hoặc để điều chế các chất diệt nấm mốc (ortho – và para – nitrophenol…)
VI. Bài tập Phenol
Bài 3 trang 193 SGK Hóa 11: Cho 14,0 gam hỗn hợp A gồm phenol và etanol tác dụng với natri dư thu được 2,24 lít khí hidro (đktc)
a. Viết các phương trình hóa học xảy ra.
b. Tính thành phần phần trăm khối lượng của mỗi chất trong A.
c. Cho 14,0 gam hỗn hợp A tác dụng với HNO3 thì thu được bao nhiêu gam axit picric (2,4,6- trinitrophenol)?
* Lời giải bài 3 trang 193 SGK Hóa 11:
– Gọi x và y lần lượt là số mol của C6H5OH và của C2H5OH
a) 2C6H5OH + 2Na → 2C6H5ONa + H2↑
x mol x/2 (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
y mol y/2 (mol)
– Theo bài ra, ta có: 94x + 46y = 14 (*)
– Theo bài ra: nH2 = 2,24/22,4 = 0,1 (mol).
– Theo PTPƯ, ta có: nH2 = (x/2) + (y/2) = 0,1 (**)
– Giải hệ PT gồm (*) và (**) ta được: x = y = 0,1 (mol)
⇒ mC6H5OH = 9,4 (g) ⇒ %mC6H5OH = (9,4/14).100% = 67,1%
⇒ mC2H5OH = 4,6 (g) ⇒ %mC2H5OH = (4,6/14).100% = 32,9%
c) Có PTHH
C6H5OH + 3HNO3 → (NO2)3C6H2OH + 3H2O
0,1 (mol) 0,1 (mol).
⇒ m(NO2)3C6H2OH = 229.0,1 = 22,9 (g).
Bài 4 trang 193 SGK Hóa 11: Cho từ từ phenol vào nước brom; stiren vào dung dịch brom trong CCl4. Nêu hiện tượng và viết các phương trình hóa học.
* Lời giải bài 4 trang 193 SGK Hóa 11:
– Khi phenol và dung dịch brom thì thấy xuất hiện kết tủa trắng
– Cho Stiren vào dung dịch brom trong CCl4 thì thấy dd Brom mất màu.
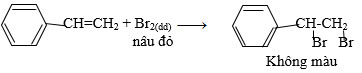
Bài 5 trang 193 SGK Hóa 11: Sục khí CO2 vào dung dịch natri phenolat thấy dung dịch vẩn đục, trong dung dịch có NaHCO3 được tạo thành. Viết phương trình hóa học của phản ứng xảy ra và giải thích. Nhận xét về tính axit của phenol.
* Lời giải bài 5 trang 193 SGK Hóa 11:
– Phương trình phản ứng:
C6H5ONa + CO2 + H2O → C6H5OH↓ + NaHCO3
– Dung dịch bị vẩn đục là do phản ứng tạo ra phenol.
– Nhận xét về tính axit của phenol: Phenol có tính axit yếu hơn nấc thứ nhất của axit cacbonic H2CO3, nên bị axit cacbonic đẩy ra khỏi dung dịch muối.
Bài 6 trang 193 SGK Hóa 11: Viết các phương trình hóa học điều chế:
– phenol từ benzen (1)
– stiren từ etylbenzen (2)
Các chất vô cơ cần thiết coi như có đủ.
* Lời giải bài 6 trang 193 SGK Hóa 11:
– (1) Điều chế phenol phenol từ benzen:
C6H6 + Br2 ![small xrightarrow[]{t^{0},Fe}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt0_1550988148-1.gif) C6H5Br + HBr
C6H5Br + HBr
C6H5Br + 2NaOH đặc ![small small xrightarrow[]{t^{0}cao,P^{ }cao}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1550988150fxl08usyz6-1.gif) C6H5ONa + NaBr + H2O
C6H5ONa + NaBr + H2O
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
– (2) Điều chế stiren từ etybenzen:
– Điều chế etylbenzen từ stiren
C6H5CH2CH3 + Br2 ![small small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1550988152rn313s2b7k-1.gif) C6H5CHBrCH3 + HBr
C6H5CHBrCH3 + HBr
C6H5CHBrCH3 + KOH ![small xrightarrow[]{C_{2}H_{5}OH,t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/15509881539z3jx41mh6-1.gif) C6H5CH=CH2 + KBr
C6H5CH=CH2 + KBr
Hy vọng với bài viết về tính chất hóa học của phenol, công thức cấu tạo và giải bài tập vận dụng ở trên giúp ích cho các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





