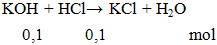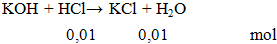Phản ứng HCl + KOH = H2O + KCl | Cân Bằng Phương Trình Hóa Học
HCl | axit clohidric | dd + KOH | kali hidroxit | dd = H2O | nước | lỏng + KCl | kali clorua | dd, Điều kiện
HCl + KOH → H2O + KCl
HCl + KOH → H2O + KCl là Phản ứng trao đổiPhản ứng trung hoà, HCl (axit clohidric) phản ứng với KOH (kali hidroxit) để tạo ra H2O (nước), KCl (kali clorua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng để HCl (axit clohidric) tác dụng KOH (kali hidroxit) là gì ?
Không có
This post: HCl + KOH → H2O + KCl
Làm cách nào để HCl (axit clohidric) tác dụng KOH (kali hidroxit)?
cho dung dịch axit HCl tác dụng với dung dịch KOH.
Nếu đang làm bài tập các bạn có thể viết đơn giản là HCl (axit clohidric) tác dụng KOH (kali hidroxit) và tạo ra chất H2O (nước), KCl (kali clorua)
Hiện tượng nhận biết nếu phản ứng xảy ra HCl + KOH → H2O + KCl là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), KCl (kali clorua) (trạng thái: dd) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia HCl (axit clohidric) (trạng thái: dd) (màu sắc: không màu), KOH (kali hidroxit) (trạng thái: dd), biến mất.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng HCl + KOH → H2O + KCl
Bazơ tan và bazơ không tan đều tác dụng với axit tạo thành muối và nước. Phản ứng giữa bazơ và axit được gọi là phản ứng trung hoà
Phương Trình Điều Chế Từ HCl Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HCl (axit clohidric) ra H2O (nước)
Phương Trình Điều Chế Từ HCl Ra KCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HCl (axit clohidric) ra KCl (kali clorua)
Phương Trình Điều Chế Từ KOH Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ KOH (kali hidroxit) ra H2O (nước)
Phương Trình Điều Chế Từ KOH Ra KCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ KOH (kali hidroxit) ra KCl (kali clorua)
Giải thích chi tiết về các phân loại của phương trình HCl + KOH → H2O + KCl
Phản ứng trao đổi là gì ?
Phản ứng hoá học trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó. Từ sự trao đổi này, chúng hình thành nên những chất mới. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố không thay đổi. Các phản ứng trao đổi không phải là phản ứng oxi hóa – khử.
Phản ứng trung hoà là gì ?
Bài tập vận dụng
Câu 1:
Cho 0,1 mol KOH phản ứng vừa đủ với 100ml HCl aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 1.
Hướng dẫn giải
a = 0,1 : 0,1 = 1M.
Đáp án D.
Câu 2:
Phản ứng nào sau đây là phản ứng trung hòa?
A. 2KOH + CO2 → K2CO3 + H2O
B. KOH + SO2 → KHSO3
C. KOH + HCl → KCl + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Hướng dẫn giải
Phản ứng trung hòa là phản ứng KOH + HCl → KCl + H2O
Đáp án C.
Câu 3:
Cho 100ml HCl 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g. B. 7,45g. C. 0,754g. D. 7,54g.
Hướng dẫn giải
mmuối = 0,01.74,5 = 0.745 gam.
Đáp án A.
Source: Mamnonanhduongvt.edu.vn
Category: Phương Trình Hoá Học Lớp 9