ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
I. LÝ THUYẾT CẦN NHỚ
1. Định luật bảo toàn khối lượng: “ Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng”
This post: Công thức bảo toàn khối lượng
Giả sử có phản ứng giữa A + B tạo ra C + D có công thức khối lượng được viết như sau :
mA + mB = mC + mD
VD: Bari clorua +natri sunphat bari sunphat + natri clorua. Có CT khối lượng là:
mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua
2. Áp dụng: trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất thì tính được khối lượng của chất còn lại.
BÀI TẬP ÁP DỤNG
Bài 1.
a. Phát biểu định luật bảo toàn khối lượng
b. Giải thích vì sao khi một phản ứng hóa học xảy ra, khối lượng các chất được bảo toàn?
Bài 2. Trong phản ứng hóa học : bari clorua + natri sunphat bari sunphat + natri clorua. Cho biết khối lượng của natri sunphat Na2SO4 là 14,2 gam, khối lượng của bari sunphat BaSO4 và natri clorua NaCl lần lượt là : 23,3 g và 11,7 g.
Hãy tính khối lượng của bari clorua BaCl2 đã phản ứng
Bài 3. Đốt cháy hết 9 gam kim loại magie Mg trong không khí thu được 15 g hỗn hợp chất magie oxit MgO. Biết rằng magie cháy là xảy ra phản ứng với oxi O2 trong không khí.
a. Viết phản ứng hóa học trên.
b. Viết công thức về khối lượng của phản ứng xảy ra.
c. Tính khối lượng của khí oxi phản ứng.
Bài 4. Đốt cháy m(g) cacbon cần 16 g oxi thì thu được 22 gam khí cacbonic. Tính m
Bài 5. Đốt cháy 3,2 g lưu huỳnh S trong không khí thu được 6,4 g lưu huỳnh đioxit. Tính khối lượng của oxi đã phản ứng.
Bài 6. Đốt cháy m g kim loại magie Mg trong không khí thu được 8g hợp chất magie oxit (MgO). Biết rằng khối lượng magie Mg tham gia bằng 1,5 lần khối lượng của oxi (không khí) tham gia phản ứng.
a. Viết phản ứng hóa học.
b. Tính khối lượng của Mg và oxi đã phản ứng.
Bài 7. Đá đôlomit (là hỗn hợp của CaCO3 và MgCO3), khi nung nóng đá này tạo ra 2 oxit là canxi oxit CaO và magie oxit MgO và thu được khí cacbon đioxit.
a. Viết phản ứng hóa học xảy ra và phương trình khối lượng nung đá đolomit.
b. Nếu nung đá đôlomit, sau phản ứng thu được 88 kg khí cacbon đioxit và 104 kg hai oxit các loại thì phải dùng khối lượng đá đôlomit là:
A. 150kg B. 16kg C. 192kg D. Kết quả khác.
Bài 8. Hãy giải thích vì sao khi nung thanh sắt thì thấy khối lượng thanh sắt tăng lên, con khi nung nóng đá vôi thấy khối lượng giảm đi.
Bài 9. Hòa tan cacbua canxi (CaC2) vào nước (H2O) ta thu được khí axetylen (C2H2) và canxi hiđroxit (Ca(OH)2).
a. Lập phương trình khối lượng cho quá trình trên.
b. Nếu dùng 41 g CaC2 thì thu được 13 g C2H2 và 37 g Ca(OH)2. Vậy phải dùng bao nhiêu mililit nước? Biết rằng khối lượng riêng của nước là 1g/ ml.
Bài 10. Khi cho Mg tác dụng với axit clohiđric thì khối lượng của magie clorua (MgCl2) nhỏ hơn tổng khối lượng của Mg và axit clohiđric tham gia phản ứng. Điều này có phù hợp với định luật bảo toàn khối lượng không?
Bài 10. Khi cho Mg phản ứng với dung dịch HCl thấy khối lượng MgCl2 nhỏ hơn tổng khối lượng của Mg và HCl. Điều này có phù hợp với định luật bảo toàn khối lượng không? Giải thích.
LỜI GIẢI
Bài 1.
a. “ Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng”
b. Giải thích: Trong phản ứng hóa học diễn ra sự thay đổi liên kết giữa các nguyên tử. Sự thay đổi này chỉ liên quan đến electron, còn số nguyên tử mỗi nguyên tố vẫn giữ nguyên và khối lượng nguyên tử không đổi. Do đó khối lượng các chất được bảo toàn.
Bài 2.
Áp dụng định luật bảo toàn khối lượng (BTKL)
mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua




Thí nghiệm
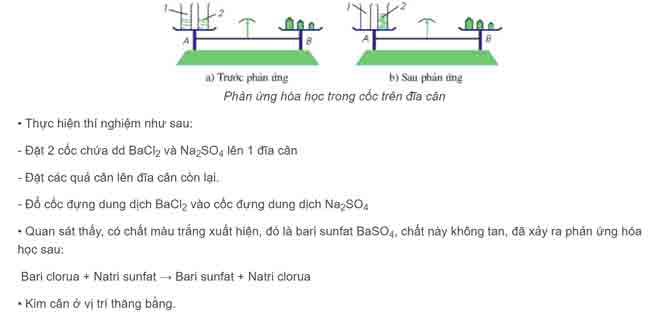




Cách tính định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng có cách tính như sau: Giả sử bạn có phản ứng giữa A + B tạo ra C + D, khi đó công thức định luật bảo toàn khối lượng sẽ được viết như sau: mA + mB = mC + mD Ví dụ thực tế để bạn dễ hiểu: Bari clorua +natri sunphat tạo ra bari sunphat + natri clorua. Khi này, chúng ta sẽ có công thức định luật bảo toàn khối lượng như sau: mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua Áp dụng định luật bảo toàn ta có kết quả: Trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất thì ta sẽ tính được khối lượng của chất còn lại.
Những dạng bài tập ứng dụng định luật bảo toàn khối lượng
Để giúp bạn áp dụng định luật bảo toàn khối lượng một cách nhuần nhuyễn nhất, hãy thực hiện những bài tập dưới đây:
4.1 Bài 1:
a. Phát biểu chính xác định luật bảo toàn khối lượng. b. Hãy giải thích vì sao khi một phản ứng hóa học xảy ra, khối lượng các chất được bảo toàn?
4.2 Bài 2:
Trong phản ứng hóa học như sau: Bari clorua + Natri sunphat tạo ra bari sunphat + natri clorua. Cho biết khối lượng của natri sunphat Na2SO4 là 14,2 gam, còn khối lượng của bari sunphat BaSO4 và khối lượng natri clorua NaCl lần lượt là : 23,3 g và 11,7 g. Bạn hãy tính khối lượng của bari clorua BaCl2 đã tham gia phản ứng.
4.3 Bài 3:
Đem đốt cháy hết 9g kim loại magie Mg trong không khí, ta thu được 15g hỗn hợp chất magie oxit MgO. Biết rằng magie cháy sẽ xảy ra phản ứng với oxi O2 ở trong không khí. a. Hãy viết phản ứng hóa học trên. b. Hãy viết công thức về khối lượng của phản ứng xảy ra ở trên. c. Hãy tính khối lượng của khí oxi đã tham gia phản ứng.
4.4 Bài 4:
Đem đốt cháy m(g) cacbon cần 16g oxi, ta thu được 22g khí cacbonic. Bạn hãy tính m.
4.5 Bài 5:
Đem đốt cháy 3,2g lưu huỳnh S ở trong không khí, ta thu được 6,4g lưu huỳnh đioxit. Bạn hãy tính khối lượng của oxi đã tham gia phản ứng.
4.6 Bài 6:
Ta đem đốt cháy m(g) kim loại magie Mg ở trong không khí, ta thu được 8g hợp chất magie oxit (MgO). Biết rằng khối lượng magie Mg khi tham gia bằng 1,5 lần khối lượng của oxi (không khí) tham gia phản ứng. a. Bạn hãy viết phản ứng hóa học. b. Hãy tính khối lượng của Mg và oxi đã tham gia phản ứng.
4.7 Bài 7:
Đá đôlomit (đây là hỗn hợp của CaCO3 và MgCO3), khi nung nóng đá này tạo ra 2 oxit là canxi oxit CaO, magie oxit MgO và thu được khí cacbon đioxit. a. Hãy viết phản ứng hóa học xảy ra, cũng như phương trình khối lượng nung đá đolomit. b. Nếu như nung đá đôlomit, sau phản ứng thu được 88 kg khí cacbon đioxit và 104 kg hai oxit các loại thì phải ta phải dùng khối lượng đá đôlomit là bao nhiêu? A. 150kg B. 16kg C. 192kg D. Kết quả khác
4.8 Bài 8:
Bạn hãy giải thích vì sao khi ta nung thanh sắt thì thấy khối lượng của thanh sắt tăng lên. Còn khi nung nóng đá vôi lại thấy khối lượng bị giảm đi?
4.9 Bài 9:
Khi hòa tan cacbua canxi (CaC2) vào nước (H2O) ta thu được khí axetylen (C2H2) và canxi hiđroxit (Ca(OH)2).a. Hãy lập phương trình khối lượng cho phản ứng trên. b. Nếu như ta dùng 41g CaC2 thì thu được 13 g C2H2 và 37 g Ca(OH)2. Vậy cần phải dùng bao nhiêu mililit nước cho phản ứng trên? Biết rằng khối lượng riêng của nước là 1g/ml.
4.10 Bài 10:
Khi cho Mg tác dụng với axit clohiđric thì khối lượng của magie clorua (MgCl2) nhỏ hơn tổng khối lượng của Mg và axit clohiđric khi tham gia phản ứng. Vậy, điều này có phù hợp với định luật bảo toàn khối lượng hay không? Bạn hãy giải thích.
Phương pháp bảo toàn khối lượng trong hóa học cực hay, có lời giải
Phương pháp giải
1. Nội dung
mtham gia = msản phẩm
Đối với bài toán sử dụng các chất dư sau phản ứng ta có:
mtrước pư = msau pư
Chú ý: Đối với các phản ứng tạo thành chất kết tủa, bay hơi, khối lượng dung dịch sẽ thay đổi sau phản ứng:
mdd sau phản ứng = mdd trước phản ứng + mchất tan – mkết tủa – mbay hơi
2. Phạm vi sử dụng
Thường sử dụng phương pháp bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban đầu ( tham gia) tính khối lượng chất tạo thành sản phẩm hoặc ngược lại
+ Trong bài toán có n chất mà chúng ta biết khối lượng của (n-1) chất ta sẽ tính được khối lượng chất còn lại
+ Những bài toán ta không thể xác định được số mol do không biết được phân tử khối của các chất
Ví dụ minh họa
Ví dụ 1: Cho 23,4 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 13,8 gam Na, thu được 36,75 gam chất rắn. Hai ancol đó là
A. C2H5OH và C3H7OH
B. C3H7OH và C4H9OH
C. C3H5OH và C4H7OH
D. CH3OH và C2H5OH
Giải:
Áp dụng định luật bảo toàn khối lượng, ta có:
mhh acol + mNa = mc/rắn + mH2
⇒ mH2 = mhh acol + mNa – mc/rắn = 23,4 + 13,8 – 36,75 = 0,45g
⇒ nH2 = 0,45/2 = 0,225 mol
⇒ nhỗn hợp ancol = 2 nH2= 2.0,225 = 0,45(mol)
M−ancol = 23,4/0,45 = 52 ⇒ 2 ancol là: C2H5OH và C3H7OH
⇒ Đáp án A
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Ngộ nhận Na tham gia phản ứng hết từ nNa ⇒ nH2 ⇒M−ancol ⇒ Đáp án D
+ Ngộ nhận chất rắn chỉ gồm muối RONa, không tính Na dư và sử dụng phương pháp tăng giảm khối lượng giữa ancol và muối ⇒ Đáp án D
Ví dụ 2: Nhiệt phân hoàn toàn m gam hỗn hợp X gồm CaCO3 và Na2CO3 thu được 11,6 gam chất rắn và 2,24 lít khí (đktc). Thành phần phần trăm khối lượng CaCO3 trong X là
A. 6,25%.
B. 8,62%.
C. 50,2%
D. 62,5%.
Giải:
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mc/rắn + mCO2= 11,6 + 0,1.44 = 16g
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
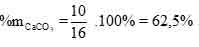
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Na2CO3 không bị nhiệt phân nhưng lại viết phương trình nhiệt phân và tính số mol khí CO2 được sinh ra từ nhiệt phân muối Na2CO3 và chất rắn gồm CaO; Na2O
Ví dụ 3: Hòa tan hoàn toàn 3,9g kali vào 36,2 gam nước thu được dung dịch có nồng độ là:
A. 15,47%
B. 13,97%
C. 14,0%
D. 4,04%
Giải:
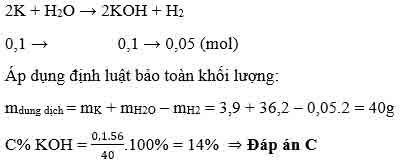
Chú ý:
Bài toán này thường mắc lỗi ở việc tính khối lượng dung dịch, quên không trừ đi khối lượng của khí H2 bay đi
Ví dụ 4: X là một α-amonoaxit, phân tử chứa một nhóm –NH2 và một nhóm –COOH. Cho 0,89g X phản ứng vừa đủ với HCl thu được 1,255g muối. Công thức cấu tạo của X là:
A. CH2 = C(NH2) – COOH
B. H2N-CH = CH – COOH
C. CH3 – CH(NH2) – COOH
D. H2N – CH2 – CH2 – COOH
Giải:
HOOC – R – NH2 + HCl → HOOC – R – NH3Cl
Áp dụng định luật bảo toàn khối lượng: mHCl = mmuối – maminoaxit = 0,365g
⇒ nHCl = naminoaxit = 0,01 mol
⇒ Maminoaxit = 0,89 : 0,01 = 89
X là α-amonoaxit ⇒ X là: CHm3 – CH(NH2) – COOH ⇒ Đáp án C
Với bài toán trên nếu không sử dụng định luật bảo toàn khối lượng quy ra số mol axit mà việc tính toán dựa trên tỉ lệ giữa muối và aminoaxit để tìm ra khối lượng phân tử của aminoaxit thì việc tính toán rất phứ tập
Ví dụ 5: Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng CO đi qua ống sứ đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 gam chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Tính giá trị m.
A. 105,6 gam.
B. 35,2 gam.
C. 70,4 gam.
D. 140,8 gam.
Giải:
Khí B gồm: COdư ( x mol) và CO2 (y mol)
nB = x + y = 0,5 mol (1)
MB = 20,4.2 = 40,8g ⇒ mB = 40,8.0,5 = 20,4g
⇒ 28x + 44y = 20,4g (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,4 mol
Ta có: nCO pư = nCO2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng:
mX + mCO = mA + mCO2
⇒ mCOX = mCOA + mCOCO2 – mCO2 = 64 + 0,4.44 – 0,4.28 = 70,4g
⇒ Đáp án C
Nếu không sử dụng định luật bảo toàn khối lượng để quy ra số mol CO2 và CO pư mà việc tính toán dựa trên đặt ẩn số mol của các oxit thì việc giải ra kết quả rất phức tạp và liên quan đến việc sử dụng toán học khá nhiều
Ví dụ 6: Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4; 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là:
A. 0,3
B. 0,2
C. 0,4
D. 0,1
Giải:
MY = 11.2 = 22
mX = 0,1.26 + 0,2,28 + 0,3.2 = 8,8g
Áp dụng định luật bảo toàn khối lượng:
mX = mY = 8,8g ⇒ nY = 8,8 : 22 = 0,4 mol
nkhí giảm = nH2 pư = nX – nY = 0,6 – 0,4 = 0,2 mol
Ta có: n = nH2 pư + nBr2 = 2nC2H2 + nC2H4 = 0,4 mol
⇒ nBr2 = 0,4 – 0,2 = 0,2 mol = a
⇒ Đáp án B
Việc áp đụng định luật bảo toàn khối lượng để thiết lập mối quan hệ số mol trước và sau phản ứng đã giúp cho bài toán thu gọn các bước giải và việc giải toán đơn giản hơn thay vì đặt ẩn các mol chất khí sau phản ứng để giải hệ
Bài tập tự luyện
Bài 1: Anđêhit mạch hở A tác dụng với H2 theo tỷ lệ mol nA:nH2=1:2 và tráng gương theo tỷ lệ mol nA:nH2=1:2. Đốt cháy hoàn toàn m gam A cần vừa đúng V lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được a gam kết tủa. liên hệ giữa m với V và a là:
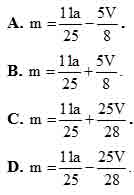

Bài 2: Có 500 ml dung dịch X chứa các ion: K+, HCO3–, Cl– và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 g.
B. 14,175 g.
C. 11,850 g.
D. 10,062 g.
Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3–
Trong 200ml dung dịch X có 0,2 mol Cl–
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3– , 0,05 mol Cl– và x mol k+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình:
2HCO3– ⇒ CO32- + CO2 + H2O.
Do đó nCO32- = 0,0375
Vậy khối lượng chất rắn khan thu được là: mK+ + mBa2+ + mCO32- + mCl– = 11,85 (gam)
⇒ Đáp án C
Bài 3: Thực hiện tổng hợp tetrapeptit từ 3,0 mol glyxin; 4,0 mol alanin và 6,0 mol valin. Biết phản ứng xảy ra hoàn toàn. Khối lượng tetrapeptit thu được là
A. 1510,5 g.
B. 1120,5 g.
C. 1049,5 g.
D. 1107,5 g.
Cứ 4 phân tử amino axit kết hợp với nhau để tạo ra tetrapeptit thì giải phóng ra 3 phân tử nước.
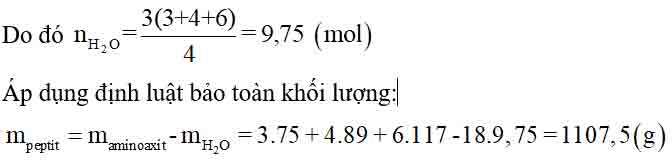
⇒ Đáp án D
Bài 4: Cho m gam butan qua xúc tác (ở nhiệt độ thích hợp), thu được hỗn hợp gồm 5 hiđrocacbon. Cho hỗn hợp khí này sục qua bình đựng dung dịch nước brom dư thì lượng brom tham gia phản ứng là 25,6 gam và sau thí nghiệm bình brom tăng 5,32 gam. Hỗn hợp khí còn lại sau khi qua dung dịch nước brom có tỉ khối so với metan là 1,9625. Giá trị của m là
A.17,4.
B.8,7.
C.5,8.
D.11,6.
Phương trình phản ứng:
C4H10 ⇒ CH4 + C3H6
C4H10 ⇒C2H4+C2H6
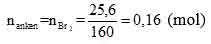
Gọi x là số mol butan còn dư. Số mol khí thoát ra khỏi bình bằng số mol butan ban đầu.
Khi đó: khối lượng khí đi ra khỏi bình là:
m = mbutan ban đầu – mkhí bị hấp thụ = 58.(x +0,16) – 5,32.
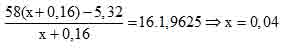
⇒mbutan ban đầu = 58(l + x) = 11,6(g) ⇒ Đáp án D
Bài 5: Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20 gam chất rắn Z và dung dịch E; cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa nung ngoài không khí nhận được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là
A. 0,24M và 0,5M.
B. 0,12M và 0,36M
C. 0,12M và 0,3M.
D. 0,24M và 0,6M.
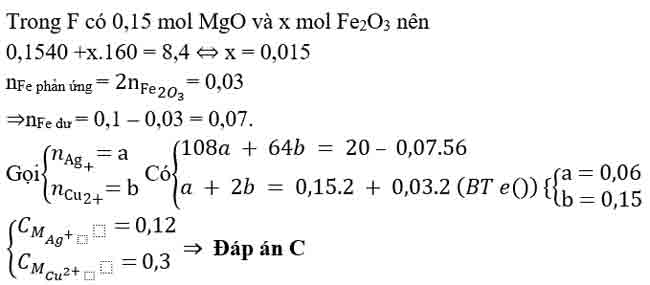
Bài 6: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là
A. 10,8 và 4,48.
B. 17,8 và 4,48.
C. 17,8 và 2,24.
D. 10,8 và 2,24.

Bài 7: Cho 3,6 gam axit cacboxylic no, đơn chức X tác dụng hoàn toàn vói 500 ml dung dịch gồm KOH 0,12M và NaOH 0,12M. Cô cạn dung dịch thu được 8,28 gam hỗn hợp chất rắn khan. Công thức phân tử của X là
A.C3H7COOH.
B.HCOOH.
C.C2H5COOH.
D.CH3COOH.
nNaOH = 0,06; nKOH =0,06
Có RCOOH + MOH ⇒ RCOOM + H2O
Theo định luật bảo toàn khối lượng ta có:
mX +mNaOH + mKOH = mrắn khan + mH2O
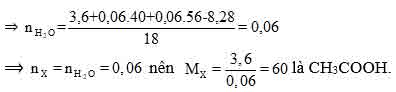
Đáp án D
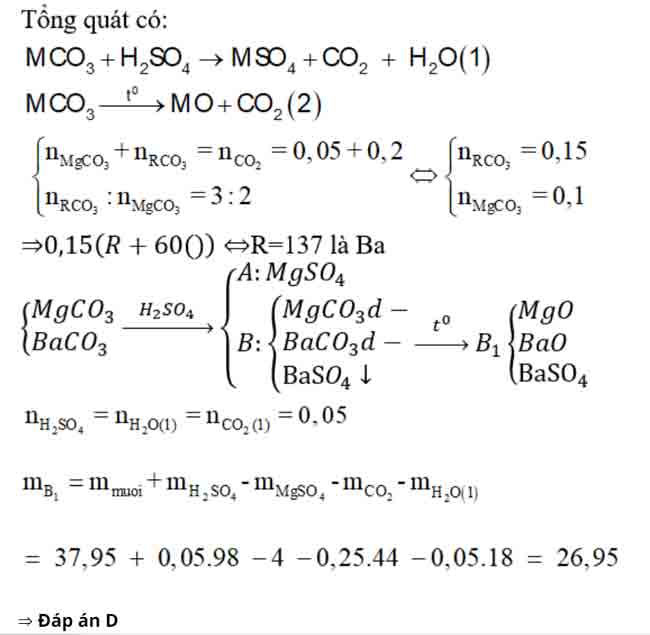
Bài 8: Cho 37,95g hỗn hợp hai muối MgCO3 và RCO3 vào 100ml dd H2SO4 loãng thấy có 1,12 lít CO2 (đktc) thoát ra, dung dịch A và chất rắn
B. Cô cạn dung dịch A thu được 4g muối khan. Nung chất rắn B đến khối lượng không đổi thì thu được rắn B1 và 4,48 lít CO2 (đktc). Biết trong hỗn hợp đầu có tỉ lệ nRCO3 : nMgCO3 = 3:2. Khối lượng chất rắn B1 và nguyên tố R là
A. 27,85g va Ba.
B. 26,95g và Ca.
C. 27,85g và Ca.
D. 26,95g và Ba.
Bài 9: Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml H2O (lỏng). Tính thành phân trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
A. 60,0% C2H5OH; 40,0% CH3COOH và hiệu suất 75%.
B. 45,0% C2H5OH; 55,0% CH3COOH và hiệu suất 60%.
C. 55,3% C2H5OH; 44,7% CH3COOH và hiệu suất 80%.
D. 53,5% C2H5OH; 46,5% CH3COOH và hiệu suất 80%.
Gọi nC2H5OH = x ; nCH3COOH = y . Đốt cháy sản phẩm cũng như đốt hỗn hợp ban đầu, theo định luật bảo toàn nguyên tố H ta có: 6nC2H5OH + 4nCH3COOH = 2nH2O

Bài 10: Lấy V (ml) dung dịch H3PO4 35% (d = 1,25 g/ml) đem trộn với 200 ml dung dịch KOH 1M thu được dung dịch chứa 14,95 (g) muối. Giá trị V là:
A. 18,48 (ml).
B. 16,8 (ml).
C. 25(ml).
D. 33,6 (ml).
Dung dịch chỉ chứa muối nên KOH và H3PO4 hết.
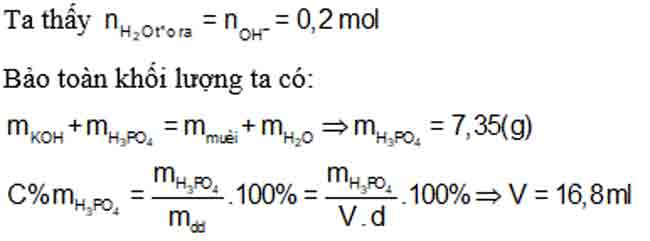
⇒ Đáp án D
Phương pháp bảo toàn khối lượng:
Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phầm.
Ví dụ. trong phản ứng kim loại tác dụng với axit → muối + H2
Áp dụng bảo toàn khối lượng ta có:
mdung dịch muối = mkim loại + mdung dịch axit – mH2
Phương pháp tăng giảm khối lượng
Dựa vào sự tăng giảm khối lượng khi chuyển từ 1 mol chất A thành 1 hoặc nhiều mol chất B (có thể qua nhiều giai đoạn trung gian) ta có thể tính được số mol của các chất và ngược lại.
Ví dụ. Xét phản ứng: Fe + CuSO4 → FeSO4 + Cu
Ta thấy: cứ 1 mol Fe (56 gam) tan ra thì có 1 mol Cu (64 gam) tạo thành, khối lượng thanh kim loại tăng 64 – 56 = 8 (gam). Như vậy nếu biết được khối lượng kim loại tăng thì có thể tính được số mol Fe phản ứng hoặc số mol CuSO4 phản ứng,…
Phương pháp sơ đồ dường chéo
Thường áp dụng trong các bai tập hỗn hợp 2 chất khí, pha trộn 2 dung dịch, hỗn hợp 2 muối khi biết nồng độ phần trăm của dung dịch (C%) hoặc phân tử khối trung bình (M).
Ví dụ. tính tỉ lệ khối lượng của 2 dung dịch có nồng độ phần trăm tương ứng là C1, C2 cần lấy trộn vào nhau để được dung dịch có nồng độ C%.(C1 2)
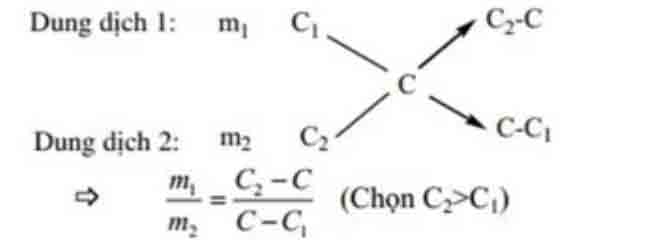
Đối với bài toán có hỗn hợp 2 chất khử, biết phân tử khối trung bình cũng nên áp dụng phương pháp sơ đồ chéo để tính số mol từng khí.
Phương pháp nguyên tử khối trung bình
Trong các bài tập có hai hay nhiều chất có cùng thành phần hóa học, phản ứng tương tự nhau có thể thay chúng bằng một chất có công thức chung, như vậy việc tính toán sẽ rút gọn được số ẩn.
– Khối lượng phân tử trung bình của một hỗn hợp là khối lượng của 1 mol hỗn hợp đó.
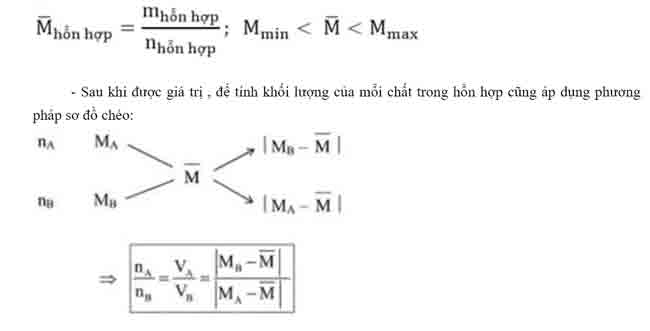
Phương pháp bảo toàn electron
Phương pháp này áp dụng để giải các bài tập có nhiều quá trình oxi hóa khử xảy ra (nhiều phản ứng hoặc phản ứng tạo ra nhiều sản phẩm hoặc phản ứng qua nhiều giai đoạn). Chỉ cần viết các quá trình nhường, nhận electron của các nguyên tố trong các hợp chất. Lập phương trình tổng số mol electron nhường = tổng số mol electron nhận.
Phương pháp bảo toàn nguyên tố
Trong các phản ứng hóa học số mol nguyên tử của các nguyên tố được bảo toàn trước và sau phản ứng.
Ví dụ. xét phản ứng CO + oxit kim loại → kim loại + CO2
Bào toàn nguyên tử O: nCO = nCO2 = nO trong các oxit
Phương pháp viết pt phản ứng dưới dạng rút gọn
Khi giải các bài toán có phản ứng của dung dịch hỗn hợp nhiều chất (dung dịch gồm 2 axit, 2 bazo,…) để tránh viết nhiều phương trình phản ứng, đơn giản tính toán ta viết phương trình ion rút gọn.
Tổng hợp ví dụ vận dụng phương pháp
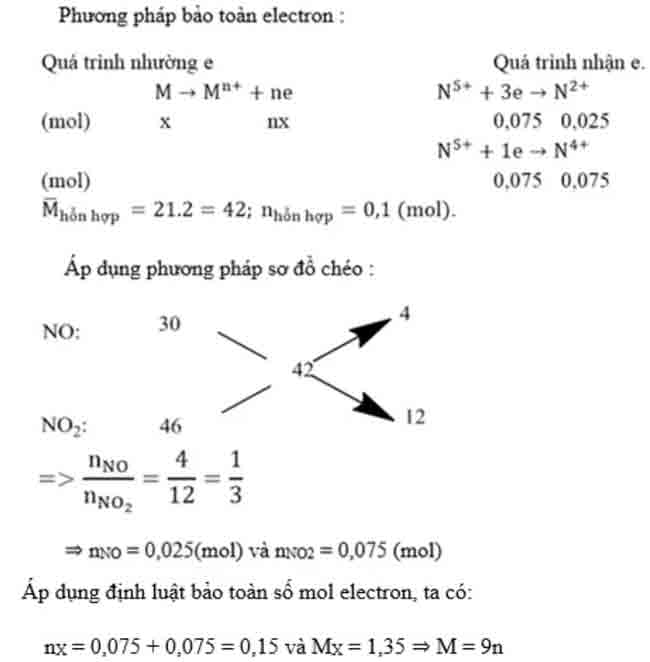
Bài 1: Hòa tan 1,35 gam một kim loại M bằng dung dịch HNO3 loãng dư thu được 2,24 lít hỗn hợp khí NO và NO2 (đktc) có tỉ khối hơi so với hidro bằng 21. Tìm M.
Hướng dẫn:
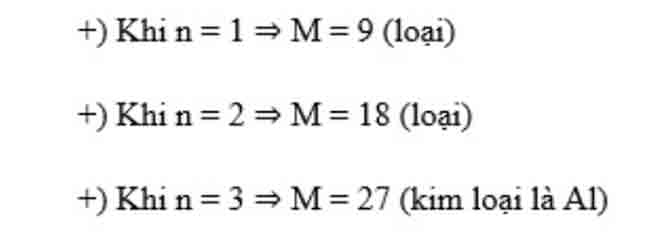
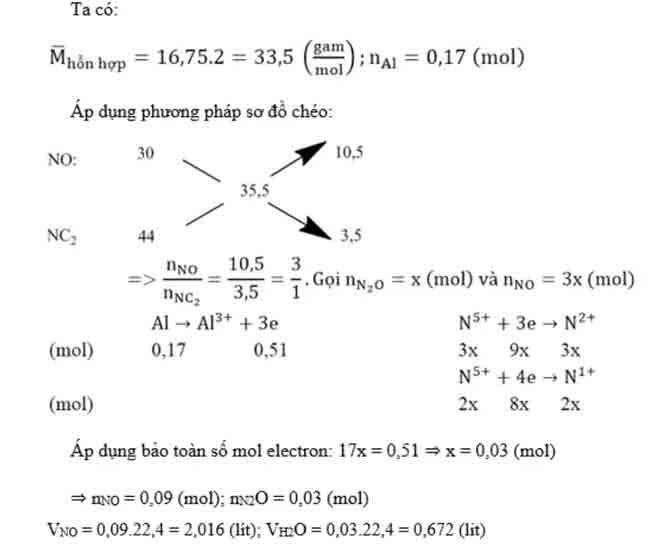
Bài 2: Hòa tan 4,59 gam nhôm trong dung dịch HNO3 1M thu được hỗn hợp X gồm hai khí NO và NO2, tỉ khối hơi của X đối với hidro bằng 16,75. Tính :
a) Thể tích mỗi khí đo ở đktc.
b) Khối lượng muối thu đươc.
c) Thể tích dung dịch HNO3 đã dùng.
Hướng dẫn:

Tổng hợp bài tập trắc nghiệm
Bài 1: Một dung dịch có chứa các ion: x mol M3+, 0,2 mol Mg2+, 0,3 mol Cu2+, 0,6 mol SO42-, 0,4 mol NO3–. Cô cạn dung dịch này thu được 116,8 gam hỗn hợp các muối khan. M là:A. Cr B. Fe. C. Al D. Zn
Đáp án: A
Áp dụng định luật bảo toàn điện tích, ta có:
3x + 0,2.2 + 0,3.2 = 0,6.2 + 0,4 ⇒ x = 0,2 mol
Ta có: mmuối = mM3+ + mMg2+ + mCu2+ + mSO42- + mNO3–
116,8 = 0,2.MM + 0,2.44 + 0,3.64 + 0,6.96 + 0,4.62
MM = 52 ⇒ M là Cr.
Bài 2: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.A. 1M B. 0,5M C. 0,25M D. 0,4M
Đáp án: B
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy nCuSO4 phản ứng = 0,8/8 = 0,1(mol) và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 3: Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đều nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.A. 14,336l B. 11,2l C. 20,16l C. 14,72l
Đáp án: A

Các định luật bảo toàn thường sử dụng

– Công thức tính số C, số H:

Lưu ý: Khi số C trung bình là số nguyên (bằng trung bình cộng của 2 số nguyên tử C) thì số mol 2 chất bằng nhau.

Kim loại + axit không có tính oxi hóa mạnh như HCl, H2SO4 loãng thì:
Số mol HCl phản ứng = 2 số mol H2 sinh ra
Số mol H2SO4 phản ứng = số mol H2 sinh ra
Khối lượng muối = khối lượng kim loại + khối lượng gốc axit
Oxit kim loại + axit không có tính oxi hóa mạnh như HCl, H2SO4 loãng
Số mol HCl phản ứng = 2 số mol H2O sinh ra
Số mol H2SO4 phản ứng = số mol H2O sinh ra
Số mol O trong oxit = số mol H2O sinh ra
Oxit kim loại + CO → kim loại + CO2
Số mol O trong oxit = số mol CO = số mol CO2
Kim loại + H2O → Bazo + H2
Số mol OH- = 2 số mol H2 thoát ra
Nếu kim loại hóa trị I thì: số mol kim loại = số mol OH-
Nếu kim loại hóa trị II thì: số mol kim loại = số mol H2
Ví dụ:
Đốt cháy m(g) Mg trong không khí, thu được 9g hợp chất magie oxit (MgO). Biết rằng khối lượng Mg tham gia bằng 2 lần khối lượng của Oxi (không khí). Tìm m?
Ta có phương trình hóa học:
Mg + 1/2O2 → MgO
Theo định luật bảo toàn khối lượng, ta có: mMg + m(không khí) = mMgO
Vì khối lượng không khí bằng một nửa khối lượng Magie,
ta có: 1.5mMg = mMgO
- mMg =2/3 mMgO = 2/3.9 = 6g
Ví dụ 2:
Đốt cháy 4(g) Canxi Ca trong không khí thu được 5,6(g) CaO. Tính khối lượng của oxi đã tham gia phản ứng?
Phương trình phản ứng:
Ca + 1/2O2 → CaO
Theo định luật bảo toàn khối lượng: mCa + mO2 = mCaO
- mO2 = mCaO – mCa = 5.6 – 4 = 1.6(g)
Vậy, khối lượng Oxi là 4(g)
Hòa tan 2.81g hỗn hợp MgO, ZnO, CaO trong 500 ml axit H2SO4 0.1M (vừa đủ). Sau phản ứng, thu được hỗn hợp muối khan, sau khi cô cạn dung dịch thì thu được muối có khối lượng là?
Ta thấy: MgO, ZnO, CaO đều có công thức chung là: XO
Phương trình phản ứng: XO + H2SO4 → XSO4 + H2O
Theo định luật bảo toàn khối lượng: mXO + mH2SO4 = mXSO4 + mH20
Ta thấy: H2SO4 → H20 → nH2O = nH2SO4 = 0.05 (mol) → mH2O = 9 (g)
Vậy: mXSO4 = mXO + mH2SO4 – mH2O = 2.81 + 0.05×98 – 9 = 6.81g
Ví dụ 2:
Hòa tan 2.13g hỗn hợp X gồm 3 kim loại Ba, Cu, Ca ở dạng bột đốt cháy hoàn toàn trong không khí thu được hỗn hợp Y gồm các oxit có khối lượng là 3.33g. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là bao nhiêu?
Cho khối lượng hỗn hợp X, hỗn hợp Y, vậy làm thế nào để vận dụng định luật bảo toàn khối lượng đây? chúng tôi sẽ giới thiệu cách giải dưới đây:
Gọi công thức chung của các kim loại trong hỗn hợp X là: M
Phương trình hóa học: 2M + n/2O2 → M2On
Theo định luật bảo toàn khối lượng, mO2 = 1.2g → nO2 = 0.0375 (mol)
Vì O → H2O → 2HCl
Nên, nHCl = 0.0755nO = 0.075×2 = 0.15(mol)
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục