Như các em đã biết, khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được AMIN. Về tính chất hóa học, AMIN có tính bazơ và có phản ứng thế ở nhóm thơm Anilin.
Ngoài các câu hỏi dạng trắc nghiệm phần lý thuyết, chúng ta cùng luyện tập qua các bài tập về AMIN với nội dung vận dụng tính chất hóa học và phản ứng đốt cháy của AMIN qua bài viết này.
This post: Các dạng bài tập về AMIN có lời giải – Hóa 12 chuyên đề
° Dạng 1: Amin tác dụng với dung dịch axit, muối
* Kiến thức vận dụng
• Bản chất của phản ứng là nhóm chức amin phản ứng với ion H+ tạo ra muối amoni (Phản ứng xảy ra tương tự với amin bậc 2, bậc 3).
-NH2 + H+ → -NH3+
• Các amin no có khả năng phản ứng được với dung dịch muối của một số kim loại tạo hidroxit kết tủa
*Ví dụ: -NH2 + Fe3+ + H2O → -NH3+ + Fe(OH)3
> Lưu ý: + NH3 không có khả năng hòa tan được Al(OH)3 (Khác với dung dịch kiềm)
+ NH3 không tạo kết tủa với muối của dung dịch đồng, bạc,…
* Bài tập 1: Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 15 gam muối. Viết số đồng phân cấu tạo của X?
* Lời giải:
– Áp dụng định luật bảo toàn khối lượng ta có:
mHCl pư = mmuối – mX
⇒ mHCl = 15 – 10 = 5 gam
⇒ nHCl = 5/36,5 (mol)
– Ta có : nX = nHCl = 5/36,5 (X là amin đơn chức nên sẽ phản ứng với HCl theo tỉ lệ 1:1)
⇒ MX = 10/ (5/36,5) = 73 (g/mol)
⇒ X là : C4H11N
* Các đồng phân của X là:
+Amin bậc 1:
CH3-CH2-CH2-CH2-NH2
CH3-CH2-CH(NH2)-CH3
CH3-CH(CH3)-CH2-NH2
(CH3)2-C(NH2)-CH3
+Amin bậc 2:
CH3-NH-CH2-CH2-CH3
CH3-NH-CH(CH3)-CH3
CH3-CH2-NH-CH2-CH3
+Amin bậc 3: (CH3)2N-CH2-CH3
* Bài tập 2: Hỗn hợp X gồm metylamin, etylamin và propylamin có tổng khối lượng 21,6 gam là và tỉ lệ về số mol là 1 : 2 : 1. Cho hỗn hợp X trên tác dụng hết với dung dịch HCl thu được dung dịch chứa bao nhiêu gam muối ?
* Lời giải:
– Vì tỉ lệ mol metylamin, etylamin và propylamin là 1:2:1 nên gọi số mol của CH3NH2 là x thì số mol C2H5NH2, C3H7NH2 lần lượt là 2x, x (mol).
– Theo bài ra, khối lượng của 3 amin là 21,6 gam, nên có:
31x + 45.2x + 59x = 21,6 ⇒ x = 0,12
– Tổng số mol của 3 amin là: 0,12 + 0,12 .2 + 0,12 = 0,48 (mol)
⇒ nHCl = nAmin = 0,48(mol).
– Áp dụng định luật bảo toàn khối lượng ta có:
mAmin + mHCl = mMuối
⇒ mMuối = 21,6 + 0,48 . 36,5 = 39,12(g).
* Bài tập 3: Cho 21,9 gam amin đơn chức X phản ứng hoàn toàn với dung dịch FeCl3 (dư), thu được 10,7 gam kết tủa. Tìm số đồng phân cấu tạo bậc 1 của X?
* Lời giải:
– Ta có phương trình phản ứng:
3RNH2 + Fe3+ + H2O → 3[RNH3]+ + Fe(OH)3 (1)
– Theo bài ra, ta có: nFe(OH)3 = m/M = 10,7/107 = 0,1 (mol)
-Theo PTPƯ: nAmin = 3nFe(OH)3 = 3.0,1 = 0,3 (mol).
⇒ Khối lượng mol của amin là: 21,9 : 0,3 = 73 gam/mol
⇒ X là C4H9NH2
⇒ Số đồng phân cấu tạo bậc 1 của X là:
CH3-CH2-CH2-CH2-NH2
CH3-CH2-CH(NH2)-CH3
CH3-CH(CH3)-CH2-NH2
CH3-C(CH3)(NH2)-CH3
° Dạng 2: Bài toán đốt cháy AMIN
* Kiến thức vận dụng:
• Ta xét amin no, đơn chức mạch hở:
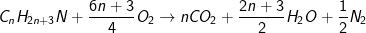
• Từ phương trình đốt cháy AMIN trên, ta thấy:
+ Tỉ lệ số mol khí CO2 và H2O là: 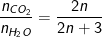
+ Số mol Amin tính theo CO2 và H2O là: 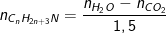
* Bài tập 1: Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Tìm công thức phân tử của 2 amin?
* Lời giải:
– Theo bài ra, ta có: nH2O = m/M = 3,6/18 = 0,2 (mol)
nCO2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
– Gọi công thức trung bình của 2 amin là: 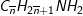
– PTPƯ cháy của amin:
![C_{overline{n}}H_{2overline{n}+3}N+(frac{6overline{n}+3}{4})O_{2}xrightarrow[]{t^0}overline{n}CO_2+frac{2overline{n}+3}{2}H_2O+frac{1}{2}N_2](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1600746692q47zh7xuqu-1.gif)
1 mol  mol
mol 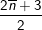 mol
mol
0,1 0,2 (mol)
• Cách 1: dựa vào chỉ số của PTPƯ:
– Theo PTPƯ ta có: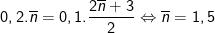
– Vì 2 amin thuộc dãy đồng đẳng liên tiếp
⇒ Công thức của 2 amin là CH3NH2 và C2H5NH2
• Cách 2: Tính theo tỉ lệ mol C trong amin
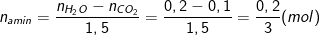
– Số nguyên tử C trung bình có trong hỗn hợp amin là:
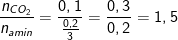
– Vì 2 amin thuộc dãy đồng đẳng liên tiếp
⇒ Công thức của 2 amin là CH3NH2 và C2H5NH2
* Bài tập 2: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. Tim CTPT của X?
* Lời giải:
nN2 = 2,8 : 22,4 = 0,125 (mol)
nAmin = nN (có trong amin) = 0,125.2 = 0,25 (mol)
n CO2 = 16,8/22,4 = 0,75 (mol)
⇒ Số nguyên tử C có trong amin là: 0,75/0,25 = 3
n H2O = 20,25/18 = 1,125 (mol)
⇒ Số nguyên tử H có trong amin là: (1,125.2) : 0,25 = 9
⇒ CTPT của amin là: C3H9N
° Dạng 3: Phản ứng của amin với HNO2 và phản ứng thế ở vòng benzen
* Kiến thức vận dụng
• Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ :
C2H5NH2+HONO→ C2H5OH + N2 + H2O
• Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 – 5oC) cho muối điazoni :
C6H5NH2+ HONO + HCl ![small xrightarrow[]{0-5^0C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1600742660ugcrprx8te_1600746718-1.gif) [C6H5N2]+Cl– + 2H2O
[C6H5N2]+Cl– + 2H2O
C6H5N2+Cl–: phenylđiazoni clorua
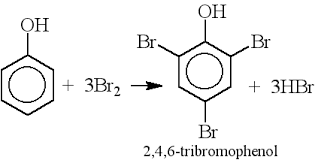
* Bài tập 1: a) Tính thể tích nước brom 3% (D=1,3g/ml) cần để điều chế 4,4 gam tribromanilin.
b) Tính khối lượng anilin có trong dung dịch A biết rằng khi cho tác dụng vào nước brom thì thu được 6,6 gam kết tủa trắng. Giả sử hiệu suất của cả hai trường hợp là 100%.
* Lời giải:
– Phương trình phản ứng:
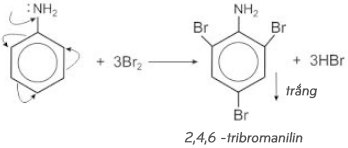
a) theo bài ra, ta có: nC6H2Br3NH3 = m/M = 4,4/330 (mol).
– Theo PTPƯ: nBr2 = 3.nC6H2Br3NH3 = (3.4,4)/330 = 13,2/330 (mol).
⇒ Khối lượng Br2 trong C6H2Br3NH3 là: mBr2 = (13,2.160)/330 = 6,4 (g).
– Từ công thức: C% = (mct/mdd).100%
⇒ Khối lượng dung dịch Br2 (3%) là: mdd Br2 = (mct)/(C%) = (6,4)/(3%) = (6,4.100/3) = 640/3 (g).
* Bài tập 2: Cho 0,1 mol etylamin tác dụng hết với dung dịch HNO2 dư thu được V lít khí N2. Tìm giá trị của V?
* Lời giải:
C2H5NH2 + HNO2 → C2H5OH + N2 + H2O
0,1 mol → 0,1 mol
⇒ V = 0,1.22,4 = 2,24 lít
* Bài tập 3: Hỗn hợp 1,07 gam hai amin đơn chức bậc nhất kế tiếp nhau trong dãy đồng đẳng phản ứng vừa hết với axit Nitrơ ở nhiệt độ thường tạo nên dung dịch X. Cho X phản ứng với Na dư thu được 0,03 mol H2. Công thức 2 amin là
* Lời giải:
– Đặt công thức trung bình của 2 amin là 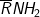
– Ta có sơ đồ phản ứng:
![underset{(a: mol)}{overline{R}NH_2}xrightarrow[]{+HNO_2}left{begin{matrix} overline{R}OH: (a: mol) H_2O: (a: mol) end{matrix}right.xrightarrow[]{+Na}frac{1}{2}H_2: (a: mol)](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1600746721kj2ovqv9a7-1.gif)
– Theo sơ đồ ta thấy số mol 2 amin là 0,03 mol, nên:
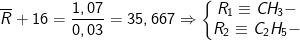
– Kết luận: Công thức 2 amin là CH3NH2 và C2H5NH2
Như vậy, với 3 dạng bài tập về Amin vận dụng các tính chất hóa học của Amin như phản ứng với axit, phản ứng với HNO2 (của amin), phản ứng thế ở vòng benzen ở trên, có thể đã giúp các em hiểu và vận dụng tốt phương pháp giải các bài tập về Amin.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục