Các dạng bài tập Hóa 10 và phương pháp giải
Chương trình hóa học lớp 10 bắt đầu giúp các em tìm hiểu sâu hơn về hóa học. Theo đó lượng lý thuyết và bài tập cũng đa dạng hơn. Vì thế các em cần làm nhiều và biết được nhiều dạng bài tập hơn, không bỏ sót những dạng bài tập cơ bản. Dưới đây là bài viết tổng hợp các dạng bài tập hóa 10 mà chúng ta cần phải lưu ý trong quá trình học.
Nội dung chính
This post: Các dạng bài tập Hóa 10 và phương pháp giải
Các dạng bài tập hóa 10
Dạng 1: Tính độ hòa tan của một chất tan trong dung dịch
Phân biệt nồng độ phần trăm và độ hòa tan, nồng độ phần trăm và nồng độ mol là một dạng toán khá thường gặp. Chúng ta cần tìm hiểu một số công thức quan trọng trước khi tiền hành làm dạng bài tập này:
-
Nồng độ phần trăm:
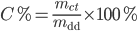
- Độ hòa tan:
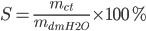
-
Nồng độ mol:
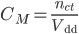
Mối liên hệ giữa C% và S:
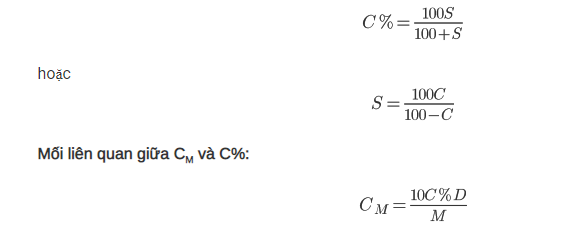
Tính khối lượng chất tan trong tinh thể ngậm nước
- Tính khối lượng tinh thể
- Tính khối lượng chất tan
- Dùng quy tắc tam suất để lập luận
Ví dụ 1: Ở 20oC, hòa tan 14,36g muối ăn vào 40g H2O được dung dịch bão hòa. Tính độ tan, nồng độ phần trăm của dung dịch bão hòa của muối ăn:
Giải
Độ hòa tan của NaCl ở 20oC là:
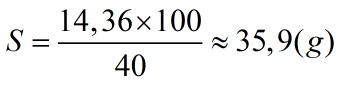
Nồng độ phần trăm của dung dịch bão hòa sẽ là:
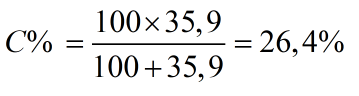
Đáp số:
- Độ tan muối: 35.9
- Nồng độ % của dd bão hòa: 26.4%
Ví dụ 2: Tính khối lượng CuSO4 trong 500g CuSO4.5H2O (Bài toán thiên về muối ngậm nước)
Giải
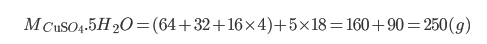
- Cứ 250g tinh thể có 160g CuSO4
- Khi đó 500g tinh thể sẽ có 320 g CuSO4
Khối lượng CuSO4 trong tinh thể là:
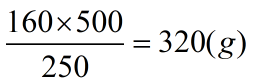
Dạng 2: Tính số oxi hóa của các hợp chất
Để làm tốt dạng bài tập này ta cần nắm vững một số qui tắc như sau:
- Số oxi hóa của đơn chất, hợp chất bằng không.
- Số oxi hóa ion: bằng điện tích ion đấy
Trong hợp chất hoặc ion đa nguyên tử:
- Số oxi hóa của H, kim loại kiềm là +1
- Số oxi hóa của O là -2
Ngoài ra, cần lưu ý một số trường hợp đặc biệt về số oxi hóa:
- Trong FeS2,H2S2 số oxi hóa của S là -1
- Trong peroxit, Na2O2, BaO2, H2O2 số oxi hóa của O là -1
- Trong Fe3O4 số oxi hóa của Fe là +8/3
Ví dụ 1: Tính số oxi hóa của Mn trong KMnO4 của S trong 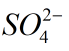
Giải
KMnO4 có số oxi hóa bằng 0. Đặt x là số oxi hóa của Mn. Ta lập phương trình như sau:
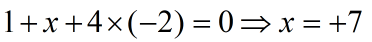
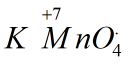
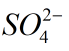 có số oxi hóa -2. Đặt x là số oxi hóa của S, lập phương trình:
có số oxi hóa -2. Đặt x là số oxi hóa của S, lập phương trình:
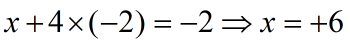
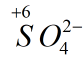
Lưu ý nho nhỏ cho bài toán trên:
- Số oxi hóa là điện tính hình thức, không phải hóa trị thực sự của nguyên tố đó trong hợp chất.
- Số oxi hóa là điện tích hình thức nên có thể nguyên, không nguyên, dương, âm hoặc bằng không.
- Trong nhiều trường hợp, giá trị tuyệt đối của số oxi hóa bằng giá trị hóa trị.
- Vì số oxi hóa là số đại số nên khi viết số oxi hóa ta đặt dấu (+) hoặc (-) trước con số; còn khi viết ion ta đặt dấu (+) hoặc (-) sau con số.
- Số oxi hóa dương cực đại trùng với số thứ tự nhóm của nguyên tố đó trong bảng tuần hoàn.
Các qui tắc trên sẽ giúp chúng ta rất nhiều trong quá trình xác định số oxi hóa của một số hợp chất phức tạp. Không còn thắc mắc trong quá trình xác định số oxi hóa khử.
Một số quy tắc khi cân bằng:
- Quy tắc số 1: Cân bằng số nguyên tử trước khi cân bằng số oxi hóa.
- Quy tắc số 2: Nếu một hợp chất có nhiều nguyên tố thay đổi oxi hóa thì ta tính sự tăng hoặc giảm số oxi hóa của từng nguyên tố rồi ghép lại thành sự tăng hoặc giảm số oxi hóa của hơp chấ.
- Quy tắc số 3: Ta có thể cân bằng theo phương pháp thăng bằng electron nghĩa là sau khi cân bằng quá trình oxi hóa bằng quá trình khử xong ta cân bằng điện tích hai vế.
- Quy tắc số 4: Chỉ có thành phần nào trong hợp chất hữu cơ có thay đổi số oxi hóa thì mới tính số oxi hóa và nên lập sơ đồ nhường, nhận electron để dễ cân bằng.
Dạng 3: Tách chất ra khỏi hỗn hợp
Trường hợp 1: Tách khí CO2: Cho hỗn hợp có khí CO2 vào dung dịch Ca(OH)2 có dư, CO2 tạo kết tủa CaCO3. Lọc, nung CaCO3 ở nhiệt độ cao để thu lại CO2
Các phương trình phản ứng diễn ra trong quá trình tách chất gồm:
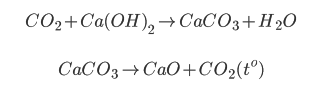
Trường hợp 2: Tách khí NH3: Cho hỗn hợp khí có NH3 vào dung dịch HCl tạo muối NH4.Cl. Cô cạn rồi nung muối NH4Cl thu lại NH3
Các phương trình phản ứng diễn ra trong quá trình tách chất gồm:
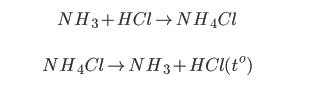
Trường hợp 3: Tinh chế muối Nacl có lẫn các chất khác: Dùng các phản ứng hóa học để chuyển các chất khác thành NaCl rồi cô cạn dung dịch để được muối NaCl nguyên chất.
Ví dụ: Tinh chế NaCl có lẫn NaBr, NaI, Na2CO3
Ta thực hiện các bước sau đây:
Hòa tan hỗn hợp vào nước tạo dung dịch hỗn hợp NaCl, NaBr, NaI, Na2CO3.
Thổi khí HCl vào chỉ có Na2CO3 phản ứng thu được là:
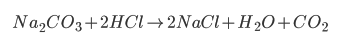
Thổi tiếp Cl2 có dư vào ta có các phản ứng sau:
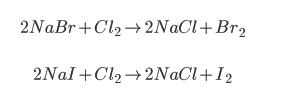
Cô cạn dung dịch H2O, Br2, I2 bay hơi hết còn lại NaCl nguyên chất. Đến đây thì quá trình tinh chế NaCl đã hoàn tất.
Dạng 4: Bài tập hiệu suất phản ứng
Trong phản ứng: Nguyên liệu A → Sản phẩm B ta có thực hiện tính một số loại hiệu suất như sau:
- Hiệu suất tính theo sản phẩm
- Hiệu suất tính theo nguyên liệu
- HIệu suất tính theo chuỗi quá trình
- Hiệu suất chung của chuỗi quá trình
Hiệu suất tính theo sản phẩm

Hiệu suất tính theo nguyên liệu

Tính hiệu suất theo chuỗi quá trình
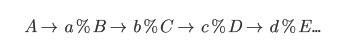
Hiệu suất chung của chuỗi quá trình là
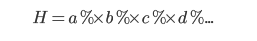
Ví dụ 1: Khi nung 200g CaCO3 thu 44g CO2. Tính hiệu suất phản ứng điều chế CO2 từ CaCO3?
Giải
CaCO3 → CaO + CO2
100g 44g
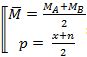
Vậy hiệu suất của quá trình điều chế CO2 từ CaCO3 là 50%.
✓ Tổng hợp các công thức hóa học 10.
Trên đây là các dạng bài tập hóa 10 mà rất hay ra trong các kì kiểm tra. Dù không thuộc dạng những câu phổ thông nhưng sẽ là câu cần thiết cho những bạn muốn lấy điểm cao và hoàn chỉnh. Các em không nên lơ là bỏ qua các dạng bài tập này.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục




