Bài tập Sắt (ký hiệu hóa học Fe) tác dụng với axit HNO3 (axit nitric) và H2SO4 (axit sunfuric) là dạng bài tập thường gặp trong hóa học vô cơ 12, tuy nhiên cũng là dạng bài tập mà nhiều bạn gặp khó khăn khi giải chúng.
Bài viết dưới đây sẽ hướng dẫn các em cách giải bài tập sắt tác dụng với axit nitric HNO3 và axit sunfuric H2SO4 để dạng toán này không thể gây khó cho các em.
This post: Bài tập Sắt (Fe) tác dụng với axit HNO3 và H2SO4 và cách giải – Hóa 12 chuyên đề
I. Cách giải bài tập sắt tác dụng với HNO3 và H2SO4
– Khi cho Fe tác dụng với HNO3, H2SO4 (đặc nóng), trình tự phản ứng xảy ra:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
– Nếu Fe dư thì tiếp tục xảy ra phản ứng:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
⇒ Khi cho Fe vào dung dịch HNO3, H2SO4 (đặc nóng), nếu sau phản ứng Fe dư thì muối sinh ra là muối Fe2+.
* Lưu ý: Khi cho Fe và hỗn hợp kim loại, trong đó có Fe tác dụng hết với dung dịch HNO3 thì:
mmuối nitrat = mKL + 62.ne(nhận)
II. Ví dụ về bài tập Sắt tác dụng với axit HNO3 và H2SO4
* Ví dụ 1: Cho 6,72 gam Fe vào 400ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hòa tan tối đa m gam Cu. Tìm m?
* Lời giải:
Đổ đơn vị: 400ml = 0,4 lít.
– Theo bài ra, ta có số mol Fe là: 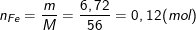
Số mol của axit nitric HNO3 là: nHNO3 = V.CM = 0,4.1 = 0,4(mol)
– Phương trình hóa học:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
0,1 0,4 0,1(mol)
Theo PTHH (1), ta thấy: nFe (dư) = 0,12 – 0,1 = 0,02(mol).
Như vậy, do Fe dư nên tiếp tục xảy ra phản ứng:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,02 0,04(mol)
Theo PTHH (2) và (1) ⇒ nFe(NO3)3 dư = 0,1 – 0,04 = 0,06(mol)
– Phương trình phản ứng hòa tan Cu:
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 (3)
0,03 ← 0,06(mol)
Vậy theo PTHH (3) thì số mol Cu được hòa tan là 0,03(mol)
⇒ Khối lượng Cu bị hòa tan là: mCu = n.M = 0,03.64 = 1,92(g)
* Ví dụ 2: Cho m(g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (đktc). Tính m?
* Lời giải:
– Theo bài ra, còn chất rắn sau phản ứng, nên Fe dư, như vậy chỉ tạo muối Fe(NO3)2.
– Các phương trình phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3 )3 → 3Fe(NO3)2
– Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN(trong HNO3) = nN trong Fe(NO3)2 + nN trong NO,NO2
Hay: 1,38 = 2.nFe(NO3)2 + 0,38
⇒ 2nFe(NO3)2 = 1,38 – 0,38 = 1
⇒ nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy khối lượng sắt tham gia phản ứng là:
mFe = 0,5.56 = 112 (g).
* Ví dụ 3: Cho 6,72 gam Fe vào axit đặc chứa 0,3 mol H2SO4, đun nóng (giả sử SO2 là sản phẩm khử duy nhất), sau khi phản ứng xảy ra hoàn toàn thu được những sản phẩm nào?
* Lời giải:
– Theo bài ra, ta có: nFe = 6,72/56 = 0,12(mol).
– Phương trình hóa học:
2Fe + 6H2SO4 → Fe2(SO3)3 + 3SO2 + 6H2O (1)
0,1 ← 0,3 → 0,05(mol)
Theo PTHH (1) ⇒ nFe (dư) = 0,12 – 0,1 = 0,02(mol) nên tiếp tục khử Fe2(SO4)3
Fe + Fe2(SO4)3 → 3FeSO4
0,02 → 0,02 0,06(mol)
– Theo PTHH (2) ⇒ nFe2(SO4)3 = 0,05 – 0,02 = 0,03(mol)
Vậy sau phản ứng thu được 0,03 mol Fe2(SO4)3 và 0,06 mol FeSO4
* Ví dụ 4: Cho a gam Fe vào 100ml dung dịch hỗn hợp gồm HNO3 0,8M và Cu(NO3)2 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92a gam hỗn hợp kim loại và khí NO (sản phẩm khử nhất của N+5). Tính a?
* Lời giải:
– Đổi đơn vị: 100ml = 0,1 lít;
Theo bài ra, ta có: nHNO3 = CM.V = 0,8.0,1 = 0,08(mol)
⇒nH+ = nHNO3 = 0,08(mol)
⇒nNO3– = nHNO3 = 0,08(mol) (1)
nCu(NO3)2 = 1.0,1 = 0,1(mol)
⇒nCu2+ = nCu(NO3)2 = 0,1(mol)
⇒nNO3– = 2nCu(NO3)2 = 0,2(mol) (2)
Từ (1) và (2) ⇒ΣnNO3– = 0,2 + 0,08 = 0,28(mol)
– Ta có PTPƯ ion thu gọn như sau:
Fe + 4H+ + NO3– → Fe3+ + NO + 2H2O
0,02 ← 0,08 → 0,02
Fe + 2Fe3+ → 3Fe2+
0,01 ← 0,02
Fe + Cu2+ → Fe2+ + Cu
0,1 ← 0,1 → 0,1
Từ các phản ứng trên ta có tổng số mol Fe tham gia phản ứng là:
nFe (pư) = 0,02 + 0,01 + 0,1 = 0,13(mol)
Suy ra khối lượng Fe tham gia phản ứng là: mFe (pư) = 0,13.56 = 7,28(g).
Khối lượng Fe dư là: mFe (dư) = mFe (ban đầu) – mFe (pư) = a – 7,28
Khối lượng hỗn hợp sau phản ứng gồm Fe dư và Cu theo bài ra là:
mhh (k.loại sau pư) = mFe (dư) + mCu = 0,92a
⇒ 0,92a = a – 7,28 + 0,1.64 ⇒ a = 11
* Ví dụ 5: Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
* Lời giải:
– Theo bài ra, ta có: 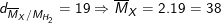
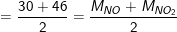
– Vì hỗn hợp Fe và Cu có khối lượng 12 gam hỗn hợp (tỉ lệ mol 1:1) nên hỗn hợp có 0,1 mol Fe (5,6g) và 0,1 mol Cu (6,4g).
– Ta có:
Fe → Fe3+ + 3e
Cu → Cu2+ + 2e
Nên ∑nelectron (do chất khử cho) = 0,1.3 + 0,1.2 = 0,5(mol)
NO2 + 3e → NO
x 3x x
NO3– + 1e → NO2
x x x
Áp dụng định luật bảo toàn electron, ta có: 4x = 0,5 ⇒ x = 0,125(mol)
Vậy: V = 0,125.2.22,4 = 5,6(lít).
Hy vọng với bài viết Bài tập Sắt (Fe) tác dụng với axit HNO3 và H2SO4 và cách giải ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để Mầm Non Ánh Dươngghi nhận và hỗ trợ, chúc các em học tốt!
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





