Ăn mòn điện hóa, ăn mòn hóa học là gì?
Chủ đề Hóa Học 12 hôm nay chúng ta sẽ tìm hiểu về hiện tượng ăn mòn điện hóa và ăn mòn hóa học, để lí giải tại sao một thanh sắt nói riêng và kim loại nói chung khi để ngoài trời hay ngâm trong nước thì lại bị rỉ sét? Đây được xem là một hiện tượng ăn mòn kim loại. Còn về chi tiết hiện tượng này, chúng ta sẽ tìm hiểu ngay sau đây.

This post: Ăn mòn điện hóa, ăn mòn hóa học là gì?
Nội dung chính
Ăn mòn kim loại
– Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kiim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học, hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương.
X —-> X(n+) + ne
– Ăn mòn kim loại gồm hai dạng là: ăn mòn hóa học và ăn mòn điện hóa học.
Ăn mòn hóa học
– Ăn mòn hóa học là quá trình oxi hóa khử trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
– Ăn mòn hóa học thường xảy ra ở các chi tiết bằng kim loại của máy móc hoặc những thiết bị thường xuyên phải tiếp xúc với hóa chất, khí oxi, hơi nước ở nhiệt độ cao. Nhiệt độ càng cao, kim loại ăn mòn càng nhanh.
– Nhận biết ăn mòn hóa học, ta thấy ăn mòn kim loại mà không thấy xuất hiện cặp kim loại hay cặp KL-C thì đó là ăn mòn kim loại.
Ví dụ: Thanh sắt nói riêng khi ngâm trong nước lại bị gỉ sét.
Đến đây chúng ta có thể giải thích như sau: Khi sắt tiếp xúc với oxy và độ ẩm trong một khoảng thời gian dài, tạo thành một hợp chất mới gọi là oxít sắt hay còn gọi là rỉ sắt. Chất xúc tác chính cho quá trình rỉ là nước. Cấu trúc sắt có vẻ chắc chắn, nhưng các phân tử nước có thể xâm nhập vào các lỗ nhỏ và vết nứt trong bất kỳ kim loại nào kể cả sắt, sự kết hợp của nguyên tử hidro có trong nước với các nguyên tố khác để hình thành axít, ăn mòn sắt, làm cho sắt bị phơi ra nhiều hơn. Nếu trong môi trường nước biển, sự ăn mòn có thể xảy ra nhanh hơn. Trong khi đó các nguyên tử oxy kết hợp với các nguyên tử sắt để hình thành oxít sắt hay rỉ sắt, chúng làm yếu sắt và làm cho cấu trúc của sắt trở nên giòn và xốp.

Ăn mòn điện hóa học
– Ăn mòn điện hóa học là quá trình oxi hóa – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dich chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
– Ăn mòn điện hóa thường xảy ra khi cặp kim loại (hoặc hợp kim) để ngoài không khí ẩm, hoặc nhúng trong dung dịch axit, dung dịch muối, trong nước không nguyên chất…
Ví dụ: Phần vỏ tàu biển chìm trong nước, ống dẫn đặt trong lòng đất, kim loại tiếp xúc với không khí ẩm… Do vậy, ăn mòn điện hóa là loại ăn mòn kim loại phổ biến và nghiêm trọng nhất
Cơ chế của ăn mòn điện hóa
– Gang hoặc thép là những hợp kim Fe-C, trong đó cực âm là những tinh thể Fe, cực dương là những tinh thể C. Các điện cực này tiếp xúc trực tiếp với nhau và với một dung dịch điện li phủ ngoài. Như vậy, vật bị ăn mòn theo kiểu điện hóa:
+ Ở cực âm: Các nguyên tử Fe bị oxi hóa thành. Các ion này tan vào dung dịch điện li trong đó đã có một lượng không khí oxi, tại đây chúng bị oxi hóa tiếp thành .
+ Ở cực dương: Các ion hiđro của dung dịch điện li di chuyển đến cực dương, tại đây chúng bị khử thành hiđro tự do, sau đó thoát ra khỏi dung dịch điện li.
Các tinh thể Fe lần lượt bị oxi hóa từ ngoài vào trong. Sau một thời gian, vật bằng gang (thép) sẽ bị ăn mòn hết.
Điều kiện để xảy ra sự ăn mòn điện hóa học
– Các điện cực phải khác nhau về bản chất, có thể là cặp 2 kim loại khác nhau hoặc cặp kim loại với phi kim,…
– Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
– Các điện cực cùng tiếp xúc với một dung dịch chất điện li
Thiếu một trong ba điều kiện trên sẽ không xảy ra sự ăn mòn điện hóa học
Trong tự nhiên, sự ăn mòn kim loại xảy ra phức tạp, có thể xảy ra đồng thời cả quá trình ăn mòn điện hóa học và ăn mòn hóa học.
Các biện pháp chống ăn mòn kim loại
Phương pháp bảo vệ bề mặt
– Dùng những chất bền vững phủ lên bề mặt kim loại như lớp sơn, dầu mỡ, chất dẻo…
– Lau chùi, để nơi khô ráo thoáng
– Sắt tây là sắt được tráng thiếc, tôn là sắt được tráng kẽm. Các đồ vật bằng sắt thường được mạ Niken hay Crom
Phương pháp điện hóa
– Dùng một kim loại là “vật hi sinh” để bảo vệ vật liệu kim loại.
VD: Để bảo vệ vỏ tàu biển bằng thép, người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện li). Kẽm bị ăn mòn, vỏ tàu được bảo vệ.
Bài tập
Bài 1: Vì sao khi nối một sợi dây điện bằng đồng với một sợi dây điện bằng nhôm thì chỗ nối mau trở nên kém tiếp xúc?
Trả lời:
Khi đồng và nhôm tiếp xúc trực tiếp nhau 1 thời gian thì tại điểm tiếp xúc ấy xảy ra hiện tượng “ăn mòn điện hoá”. Hiện tượng này làm phát sinh một chất có điện trở lớn, làm giảm dòng điện đi qua dây.
Bài 2: Một hợp kim có cấu tạo tinh thể hỗn hợp Cu – Zn để trong không khí ẩm. Hãy cho biết hợp kim bị ăn mòn hoá học hay điện hoá học.
Trả lời:
Hợp kim bị ăn mòn điện hoá học.
Zn là điện cực âm, bị ăn mòn. Cu là điện cực dương không bị ăn mòn.
Bài 3: Có những cặp kim loại sau đây tiếp xúc với nhau và cùng tiếp xúc với dung dịch điện li. Cho biết kim loại nào trong mỗi cặp sẽ bị ăn mòn điện hoá học.
a) Al – Fe
b) Cu – Fe
c) Fe – Sn
Trả lời:
a) Al (điện cực âm) bị ăn mòn, Fe (điện cực dương) không bị ăn mòn
b) Fe (điện cực âm) bị ăn mòn, Cu (điện cực dương) không bị ăn mòn.
c) Fe (điện cực âm) bị ăn mòn, Sn (điện cực dương) không bị ăn mòn.
Ở những vết sây sát của vật làm bằng sắt tráng kẽm sẽ xảy ra hiện tượng ăn mòn điện hoá học.
Bài 4: Ngâm 9 g hợp kim Cu – Zn trong dung dịch axit HCl dư thu được 896 ml khí H2 (đktc). Hãy xác định thành phần phần trăm khối lượng của hợp kim.
Trả lời:
Zn + 2H+ → Zn2+ + H2
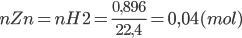
=> mZn = 0,04.65 = 2,6 (g)
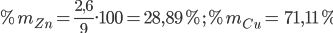
Sau khi học xong bài này, chúng ta đã có thể hiểu rõ hơn về những sự việc xảy ra hằng ngày xung quanh chúng ta, cùng như có thể giải thích được chúng. Ngoài ra, còn một số dạng bài tập hay được hỏi trong chủ đề sự ăn mòn điện hóa này. Các em nên sưu tầm và luyện tập thêm để có kết quả thật tốt nhé. Chúc các em học tốt!
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





