So sánh tính chất hóa học và tính chất vật lý của Oxi (O) và lưu huỳnh (S). Oxi và lưu huỳnh là hai trong những nguyên tố phi kim quan trọng có nhiều ứng dụng trong đời sống thực tế.
Bài viết dưới đây chúng ta cùng so sánh tính chất hóa học và tính chất vật lý của oxi và lưu huỳnh để hệ thống lại kiến thức của hai nguyên tố phi kim quan trọng này.
This post: So sánh tính chất hóa học và tính chất vật lý của Oxi (O) và lưu huỳnh (S) – Hóa lớp 10
Oxi có vai trò quyết định đối với sự sống của con người và động vật. mỗi người cần 20-30m3 không khí để thở mỗi ngày. Còn lưu huỳnh được ứng dụng nhiều trong công nghiệp như: sản xuất axit sunfuric, sản xuất chất tẩy trắng bột giấy, diêm, dược phẩm, phẩm nhuộn,…
I. So sánh tính chất vật lý của Oxi và lưu huỳnh
• Tính chất vật lý của oxi
– Oxi là một chất không màu, không mùi.
– Oxi là một chất ít tan trong nước (1 lít nước ở 20°C hòa tan được 3 ml khí oxi).
– Oxi nặng hơn không khí (dO2/KK = 32/29).
– Khi hóa lỏng ở nhiệt độ -183 độ C, oxi sẽ có màu xanh nhạt và ở dạng lỏng và có thể bị hút bởi nam châm.
• Tính chất vật lý của lưu huỳnh
– Lưu huỳnh là chất rắn màu vàng, giòn, thực tế không tan trong nước, không thấm nước nhưng tan nhiều trong các dung môi hữu cơ như : rượu, benzen…, dẫn điện và dẫn nhiệt kém.
– Lưu huỳnh có hai dạng thù hình(lưu huỳnh Sαtà phương, lưu huỳnh Sβđơn tà) và dạng vô định hình (lưu huỳnh dẻo).
– Lưu huỳnh sôi ở 444,6oC tạo thành hơi màu đỏ nâu. Nếu làm nguội nhanh thì hơi lưu huỳnh chuyển thành bột mịn, gồm những tinh thể nhỏ, gọi là lưu huỳnh hoa.Ở trạng thái rắn, mỗi phân tử lưu huỳnh gồm 8 nguyên tử (S8) khép kín thành vòng.
–Do mạng tinh thể lưu huỳnh là mạng phân tử nên lưu huỳnh nóng chảy ở nhiệt độ tương đối thấp 112,8oC, chỉ cao hơp nhiệt độ sôi của nước một ít. Nếu tiếp tục đun nóng đến 187oC lưu huỳnh lỏng trở nên sẫm, có màu vàng nâu và đặc lại, gọi là lưu huỳnh dẻo. Đó là một dạng thù hình của lưu huỳnh. Trong lưu huỳnh dẻo phân tử lưu huỳnh có cấu tạo mạch rất dài giống như phân tử cao su nên lưu huỳnh có tính đàn hồi.
–Như vậy, tồn tại những phân tử lưu huỳnh có thành phần khác nhau. Để đơn giản, ta chỉ viết phân tử lưu huỳnh gồm 1 nguyên tử S.
I. So sánh tính chất hóa học của Oxi và lưu huỳnh
• Oxi và lưu huỳnh là những nguyên tố phi kim có tính oxi hóa mạnh:O>SO>S
– Oxi oxi hóa hầu hết kim loại, nhiều phi kim, nhiều hợp chất.
– Lưu huỳnh oxi hóa nhiều kim loại, một số phi kim.
• Khác với oxi, lưu huỳnh còn thể hiện tính khử khi tác dụng với những nguyên tố có độ âm điện lớn hơn như O, F.
*Tính chấthóa họccủa oxi
–Oxi tác dụng với phi kim
Oxi tác dụng với nhiều phi kim như H, S, P,… ở nhiệt độ cao.
S + O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) SO2
SO2
4P + 5O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) 2P2O5
2P2O5
2H2+ O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) 2H2O
2H2O
–Oxi tác dụng với kim loại
Oxi tác dụng với nhiều kim loại ở nhiệt độ cao:
3Fe + 2O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) Fe3O4
Fe3O4
2Cu + O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) 2CuO
2CuO
2Mg + O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) 2MgO
2MgO
–Oxi tác dụng với hợp chất
Oxi là phi kim hoạt động mạnh, ở nhiệt độ cao nó tác dụng với nhiều hợp chất.
CH4+ 2O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) CO2+ 2H2O
CO2+ 2H2O
4FeS2+ 11O2![small xrightarrow[]{t^0}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1631937035kq2fzan1s9-1.gif) Fe2O3+ 8SO2
Fe2O3+ 8SO2
*Tính chất hóa học của lưu huỳnh
– Là một phi kim khá hoạt động. Lưu huỳnh vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
• Lưu huỳnh thể hiện tính oxi hóa
i) Tác dụng với kim loại.
– Lưu huỳnh dễ tạo ra hợp chất với nhiều kim loại, thường là khi đun nóng.
* Ví dụ: Hỗn hợp gồm bột sắt và bột lưu huỳnh nếu được đun nhẹ lúc đầu thì phản ứng xảy ra rất mạnh, toả nhiều nhiệt:
Fe + S→FeS
– Phản ứng giữa lưu huỳnh với nhôm hoặc với kẽm cũng xảy ra mãnh liệt kèm theo sự loé sáng. Những sợi dây đồng mảnh có thể cháy trong hơi lưu huỳnh tạo ra CuS màu đen.
– Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường:
Hg + S→HgS
– Hợp chất của lưu huỳnh với kim loại thuộc loại muối, gọi là sunfua (FeS – sắt sunfua, Al2S3– nhôm sunfua, …..)
ii) Tác dụng với hidro
– Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua:
H2 + S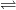 H2S
H2S
– Phản ứng này không thực hiện đến cùng.
• Lưu huỳnh thểhiện tính khử
i) Tác dụng với phi kim
– Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot.
– Khi bị đốt, lưu huỳnh cháy trong không khí với ngọn lửa màu xanh, tạo ra lưu huỳnh (IV) oxit :
S + O2→ SO2
– Trong các oxit SO2và SO3, do độ âm điện của lưu huỳnh (2,5) nhỏ hơn của oxi nên liên kết cộng hoá trị giữa oxi và lưu huỳnh là có cực, số oxi hoá của lưu huỳnh trong các oxit đó là +4 và +6.
ii)Tác dụng với các chất oxi hóa khác
* Ví dụ: 3S + 2KClO3→2KCl + 3SO2
S + 6HNO3(đặc)→H2SO4+ 6NO2+ 2H2O.
Như vậy với bài viết so sánh tính chất vật lý và tính chất hóa học của Oxi và lưu huỳnh này, Mầm Non Ánh Dương hy vọng giúp các em hệ thống được kiến thức về 2 phi kim quan trọng này, chúc các em học tốt.
Xem thêm So sánh tính chất hóa học và tính chất vật lý của Oxi (O) và lưu huỳnh (S)
So sánh tính chất hóa học và tính chất vật lý của Oxi (O) và lưu huỳnh (S). Oxi và lưu huỳnh là hai trong những nguyên tố phi kim quan trọng có nhiều ứng dụng trong đời sống thực tế. Bài viết dưới đây chúng ta cùng so sánh tính chất hóa học và tính chất vật lý của oxi và lưu huỳnh để hệ thống lại kiến thức của hai nguyên tố phi kim quan trọng này. Oxi có vai trò quyết định đối với sự sống của con người và động vật. mỗi người cần 20-30m3 không khí để thở mỗi ngày. Còn lưu huỳnh được ứng dụng nhiều trong công nghiệp như: sản xuất axit sunfuric, sản xuất chất tẩy trắng bột giấy, diêm, dược phẩm, phẩm nhuộn,… I. So sánh tính chất vật lý của Oxi và lưu huỳnh • Tính chất vật lý của oxi – Oxi là một chất không màu, không mùi. – Oxi là một chất ít tan trong nước (1 lít nước ở 20°C hòa tan được 3 ml khí oxi). – Oxi nặng hơn không khí (dO2/KK = 32/29). – Khi hóa lỏng ở nhiệt độ -183 độ C, oxi sẽ có màu xanh nhạt và ở dạng lỏng và có thể bị hút bởi nam châm. • Tính chất vật lý của lưu huỳnh – Lưu huỳnh là chất rắn màu vàng, giòn, thực tế không tan trong nước, không thấm nước nhưng tan nhiều trong các dung môi hữu cơ như : rượu, benzen…, dẫn điện và dẫn nhiệt kém. – Lưu huỳnh có hai dạng thù hình(lưu huỳnh Sαtà phương, lưu huỳnh Sβđơn tà) và dạng vô định hình (lưu huỳnh dẻo). – Lưu huỳnh sôi ở 444,6oC tạo thành hơi màu đỏ nâu. Nếu làm nguội nhanh thì hơi lưu huỳnh chuyển thành bột mịn, gồm những tinh thể nhỏ, gọi là lưu huỳnh hoa.Ở trạng thái rắn, mỗi phân tử lưu huỳnh gồm 8 nguyên tử (S8) khép kín thành vòng. –Do mạng tinh thể lưu huỳnh là mạng phân tử nên lưu huỳnh nóng chảy ở nhiệt độ tương đối thấp 112,8oC, chỉ cao hơp nhiệt độ sôi của nước một ít. Nếu tiếp tục đun nóng đến 187oC lưu huỳnh lỏng trở nên sẫm, có màu vàng nâu và đặc lại, gọi là lưu huỳnh dẻo. Đó là một dạng thù hình của lưu huỳnh. Trong lưu huỳnh dẻo phân tử lưu huỳnh có cấu tạo mạch rất dài giống như phân tử cao su nên lưu huỳnh có tính đàn hồi. –Như vậy, tồn tại những phân tử lưu huỳnh có thành phần khác nhau. Để đơn giản, ta chỉ viết phân tử lưu huỳnh gồm 1 nguyên tử S. I. So sánh tính chất hóa học của Oxi và lưu huỳnh • Oxi và lưu huỳnh là những nguyên tố phi kim có tính oxi hóa mạnh:O>SO>S – Oxi oxi hóa hầu hết kim loại, nhiều phi kim, nhiều hợp chất. – Lưu huỳnh oxi hóa nhiều kim loại, một số phi kim. • Khác với oxi, lưu huỳnh còn thể hiện tính khử khi tác dụng với những nguyên tố có độ âm điện lớn hơn như O, F. *Tính chấthóa họccủa oxi –Oxi tác dụng với phi kim Oxi tác dụng với nhiều phi kim như H, S, P,… ở nhiệt độ cao. S + O2 SO2 4P + 5O2 2P2O5 2H2+ O2 2H2O –Oxi tác dụng với kim loại Oxi tác dụng với nhiều kim loại ở nhiệt độ cao: 3Fe + 2O2 Fe3O4 2Cu + O2 2CuO 2Mg + O2 2MgO –Oxi tác dụng với hợp chất Oxi là phi kim hoạt động mạnh, ở nhiệt độ cao nó tác dụng với nhiều hợp chất. CH4+ 2O2 CO2+ 2H2O 4FeS2+ 11O2 Fe2O3+ 8SO2 *Tính chất hóa học của lưu huỳnh – Là một phi kim khá hoạt động. Lưu huỳnh vừa thể hiện tính khử vừa thể hiện tính oxi hóa. • Lưu huỳnh thể hiện tính oxi hóa i) Tác dụng với kim loại. – Lưu huỳnh dễ tạo ra hợp chất với nhiều kim loại, thường là khi đun nóng. * Ví dụ: Hỗn hợp gồm bột sắt và bột lưu huỳnh nếu được đun nhẹ lúc đầu thì phản ứng xảy ra rất mạnh, toả nhiều nhiệt: Fe + S→FeS – Phản ứng giữa lưu huỳnh với nhôm hoặc với kẽm cũng xảy ra mãnh liệt kèm theo sự loé sáng. Những sợi dây đồng mảnh có thể cháy trong hơi lưu huỳnh tạo ra CuS màu đen. – Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường: Hg + S→HgS – Hợp chất của lưu huỳnh với kim loại thuộc loại muối, gọi là sunfua (FeS – sắt sunfua, Al2S3– nhôm sunfua, …..) ii) Tác dụng với hidro – Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua: H2 + S H2S – Phản ứng này không thực hiện đến cùng. • Lưu huỳnh thểhiện tính khử i) Tác dụng với phi kim – Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot. – Khi bị đốt, lưu huỳnh cháy trong không khí với ngọn lửa màu xanh, tạo ra lưu huỳnh (IV) oxit : S + O2→ SO2 – Trong các oxit SO2và SO3, do độ âm điện của lưu huỳnh (2,5) nhỏ hơn của oxi nên liên kết cộng hoá trị giữa oxi và lưu huỳnh là có cực, số oxi hoá của lưu huỳnh trong các oxit đó là +4 và +6. ii)Tác dụng với các chất oxi hóa khác * Ví dụ: 3S + 2KClO3→2KCl + 3SO2 S + 6HNO3(đặc)→H2SO4+ 6NO2+ 2H2O. Như vậy với bài viết so sánh tính chất vật lý và tính chất hóa học của Oxi và lưu huỳnh này, Mầm Non Ánh Dương hy vọng giúp các em hệ thống được kiến thức về 2 phi kim quan trọng này, chúc các em học tốt. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức