Cu + HNO3 → Cu(NO3)2 + NO + H2O là phản ứng oxi hóa khử, được Mầm Non Ánh Dương biên soạn, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học 10, tính chất Hóa học của Cu và tính chất hóa học HNO3…. cũng như các dạng bài tập.
Hy vọng có thể giúp các bạn viết và cân bằng phương trình một cách nhanh và chính xác hơn.
This post: Cu + HNO3 → Cu(NO3)2 + NO + H2O
Mời các bạn tham khảo một số tài liệu quan đến cân bằng phản ứng
1. Phương trình phản ứng Cu tác dụng HNO3 loãng
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
2. Cân bằng phương trình phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O
Xác định sự thay đổi số oxi hóa
Cuo + HN+5O3 → Cu+2(NO3)2 + N+2O + H2O
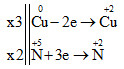
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Nhắc lại kiến thức:Các bước cân bằng phản ứng bằng phương pháp thăng bằng electron
Bước 1. Viết sơ đồ phản ứng với các chất tham gia xác định nguyên tố có số oxi hóa thay đổi
Bước 2. Viết phương trình:
Khử (Cho electron)
Oxi hóa (nhận electron)
Bước 3. Cân bằng electron: Nhân hệ số để
Tổng số electron cho = tổng số electron nhận
Bước 4. Cân bằng nguyên tố: nói chung theo thứ tự
Kim loại (ion dương)
Gốc axit (ion âm)
Môi trường (axit, bazo)
Nước (cân bằng H2O là để cân bằng hidro)
Bước 5. Kiểm tra số nguyên tử oxi ở hai vế (phải bằng nhau)
3. Điều kiện phản ứng Cu tác dụng với HNO3
Dung dịch HNO3 loãng dư
4. Phương trình ion thu gọn Cu tác dụng HNO3 loãng
3Cu + 8H+ + 2NO3– → 3Cu2+ + 2NO↑ + 4H2O
5. Cách tiến hành phản ứng cho Cu tác dụng HNO3
Cho đồng Cu tác dụng với dung dịch axit nitric HNO3
6. Hiện tượng cho Cu tác dụng HNO3 loãng
Kim loại Cu rắn đỏ dần tạo thành dung dịch màu xanh lam và khí không màu hóa nâu trong không khí thoát ra.
7. Tính chất hóa học của HNO3
Axit nitric thể hiện tính axit
Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + BaCO3 → Ba(NO3)2 + H2O + CO2
Tính oxi hóa của HNO3
- Axit nitric tác dụng với kim loại
Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Mg + HNO3 đặc
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Axit nitric Tác dụng với phi kim
(Các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
- Tác dụng với hợp chất
3H2S + 2HNO3 (>5%) → 3S ↓+ 2NO + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
8. Bài tập vận dụng liên quan
Câu 1. Ứng dụng nàosau đây không phải của HNO3?
A. Để điều chế phân đạm NH4NO3, Ca(NO3)2
B. Sản xuất dược phẩm
C. Sản xuất khí NO2 và N2H4
D. Để sản xuất thuốc nổ, thuốc nhuộm
Câu 2.Phát biểu nào sau đây đúng:
A. Dung dịch HNO3 làm xanh quỳ tím và làm phenolphtalein hóa đỏ.
B. Axit nitric được dùng để sản xuất phân đạm (NH4NO3, Ca(NO3)2), thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
C. Trong công nghiệp, để sản xuất HNO3 người ta đun hỗn hợp (KNO3) với H2SO4 đặc
D. điều chế HNO3 trong phòng thí nghiệm người ta dùng khí amoniac (NH3)
Chọn B: Axit nitric được dùng để sản xuất phân đạm (NH4NO3, Ca(NO3)2), thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
A Sai: dung dịch HNO3 chỉ làm xanh quỳ tím hóa đỏ.
C. Trong công nghiệp để sản xuất axit nitric, người ta thường đun nóng hỗn hợp natri nitrat rắn với dung dịch H2SO4 đặc
D. Để điều chế HNO3 trong phòng thí nghiệm người ta dùng NaNO3 và H2SO4đặc
Câu 3. Trong các thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta sử dụng biện pháp nhét bông có tẩm hóa chất và nút ống nghiệm. Hóa chất đó chính là
A. H2O
B. Dung dịch nước vôi trong
C. dung dịch giấm ăn
D. dung dịch muối ăn
4NO2 + 2Ca(OH)2 → Ca(NO3)2 + 2H2O + Ca(NO2)2
Khí màu nâu đỏ NO2 bị hòa tan trong dung dịch, tạo thành chất rắn Ca(NO2)2 và Ca(NO3)2
Câu 4.Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3:
A. HCl
B. HNO3
C. KBr
D. K3PO4
Phương trình phản ứng
AgNO3 + HCl → AgCl + HNO3
AgNO3 + KBr → AgBr + KNO3
3AgNO3 + K3PO4 → Ag3PO4 + 3KNO3
Câu 5. Cho 19,2 gam Cu tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Phương trình hóa học
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
2nCu = 3nNO
=> nNO = 0,2 mol
=> V = 4,48 lit
Câu 6. Cho phương trình hóa học sau: Fe + HNO3 → Fe(NO3)3 + NO + H2O
Tổng hệ số tối giản của phương trình sau:
A. 8
B. 9
C. 12
D. 16
Câu 7. Cho Cu (z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB.
B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB.
D. ô 29, chu kỳ 4, nhóm IIB.
Nguyên tố X có Z = 29 => Cấu hình X là 1s22s22p63s23p63d104s1
=> X thuộc ô thứ 29, chu kì 4, phân nhóm IB
Câu 8. Nhận định nào sau đây là sai?
A. Đồng dẻo, dễ kéo sợi.
B. Đồng là kim loại có màu đen.
C. Đồng có thể dát mỏng hơn giấy viết từ 5 đến 6 lần.
D. Đồng dẫn nhiệt, điện tốt.
Câu 9. Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Các dung dịch phản ứng được với Cu(OH)2 là HCl, NH3
Cu(OH)2 + HCl → CuCl2 + H2O
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Câu 10. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dd HNO3 loãng
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh lam, có khí không màu bay ra, bị hoá nâu trong không khí.
Phương trình hóa học
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
→ Hiện tượng: Dung dịch có màu xanh của Cu(NO3)2 và khí màu nâu đỏ NO2.
Câu 11. Hòa tan m gam Al vào dung dịch HNO3 loãng vừa đủ, thu được 17,92 lít (đktc) hỗn hợp khí X gồm N2O và N2 biết tỉ khối hơi của X so với H2 là 18 (không còn sản phẩm khử nào khác) và dd Y chứa a gam muối nitrat. Giá trị của m là.
A. 21,6
B. 97,2
C. 64,8
D. 194,4
Nhận thấy MX = (MN2 + MN2O)2 = (28 + 44)/2=36
=> nN2 = nN2O = 0,24 / 2 = 0,12 mol
Ta có: mAl(NO3)3= 213.m/27 = 7,89m < 8 => trong muối có NH4NO3
Bảo toàn e: 3nAl = 10nN2 + 8nN2O + 8nNH4NO3
=> 3.m/27 =10.0,12 + 8.0,12 + 8nNH4NO3
→ nNH4NO3 = m/72 − 0,27
Khối lượng muối tạo thành: mmuối = mAl(NO3)3 + mNH4NO3
=> 8m = 213.m/27 + 80.(m/72 – 0,27) => m = 21,6 gam
Câu 12. Kim loại nào sau đây không tác dụng được với dd HNO3 đặc, nguội
A. Cr
B. Cu
C. Zn
D. Ag
Câu 13. Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3 .
D. 4.
1. Sai vì Cu không tác dụng với HCl.
2. Đúng
3. Đúng, Cu + 2FeCl3 → CuCl2 + 2FeCl2
4. Đúng, 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
5. Sai, đồng thuộc nhóm kim loại nặng
6. Sai, có tồn tại 2 chất trên
Câu 14. Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2.
B. 3.
C. 4.
D. 1.
2Cu(NO3)2 → 2CuO + 4NO2 (4x) + O2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu = mchất rắn sau + mkhí
→ 6,58 = 4,96 + 46.4x + 32x → x = 0,0075 mol
Dẫn khí X vào nước
O2 (0,0075) + 4NO2 (0,03) + 2H2O → 4HNO3 (0,03 mol)
CM (HNO3) = 0,03 : 0,3 = 0,1 → pH = 1.
Câu 15. Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
A. 2,16 gam.
B. 0,84 gam.
C. 1,72 gam.
D. 1,40 gam.
Fe (0,01) + 2Ag+ → Fe2+ + 2Ag (0,02 mol) (1)
mtăng (1) = 0,02.108 – 0,01.56 = 1,6 gam
Theo bài ra mKL tăng = 101,72 – 100 = 1,72 gam.
Tiếp tục có phản ứng:
Fe (a) + Cu2+ → Fe2+ (a mol) + Cu
mtăng (2) = 64a – 56a = 1,72 – 1,6 → a = 0,015 mol
→ mFe = (0,01 + 0,015).56 = 1,4 gam.
Câu 16. Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot.
B. ure.
C. natri nitrat.
D. amoni nitrat.
Amoni nitrat NH4NO3
3Cu + 8H+ + 2NO3– → 3Cu2+ + 2NO↑ + 4H2O
NH4+ + OH– → NH3↑ + H2O
Câu 17. Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào?
A. Tăng.
B. Giảm.
C. Không thay đổi.
D. không xác định được.
Giả sử có 1 mol Cu tham gia phản ứng
Cu (1) + 2AgNO3 → Cu(NO3)2 + 2Ag↓ (2 mol)
→ khối lượng thanh đồng tăng = 2 × 108 – 64 = 152 gam.
Câu 18. Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là:
A. 2,24
B. 5,60
C. 3,36
D. 4,48
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64 x = 12 ⇒ x = 0,1 mol
Mặt khác:
Đặt x, y là số mol của NO và NO2 thì 30x + 46 y = 38 (x+ y)
⇒ x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 ⇒ 4x = 0,5 .
Vậy x= 0,125 mol
V = 0,125.2. 22.4= 5,6 lít
Câu 19. Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 11,2 gam
B. 10,2 gam
C. 7,2 gam
D. 6,9 gam
Đáp án A
Cách 1: Quy đổi hổn hợp X về hai chất FeO và Fe2O3
Phương trình hóa học
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
0,1 0,1
nFe = 8,4/ 56 = 0,15mol
Ta có:
2Fe + O2 → 2FeO
0,1 0,2
4Fe + 3O2 → 2Fe2O3
0,05 0,025 mol
⇒mH2X = 0,1.72 + 0,025.160 = 11,2 g
Cách 2: Quy hỗn hợp X về một chất FexOy:
FexOy + (6x – 2y) HNO3 → xFe(NO3)3 + (3x – 2y) NO2 + (3x -y) H2O
0,1/3x−2y 0,1mol
Áp dụng định luật bảo toàn nguyên tố sắt:
Fe = 8,4/56 = 0,1.x/3x−2y ⇒ x/y = 6/7
Vậy công thức quy đổi là: Fe6O7 (M = 448) và
nFe6O7 = 0,13.6 − 2.7 = 0,025 mol
=> mX = 0,025 . 448 = 11,2g
Câu 20. Để nhận biết ion người ta thường dùng Cu và dung dịch HNO3loãng và đun nóng, vì:
A. Phản ứng tạo ra dung dịch có màu vàng nâu
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm
C. Phản ứng tạo ra kết tủa màu xanh
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hoá nâu trong không khí.
Để nhận biết ion NO3– người ta thường dùng Cu và dung dịch H2SO4 loãng nhờ phản ứng tạo dung dịch màu xanh và khí không màu hóa nâu trong không khí.
3Cu + 8H+ + 2NO3– → 3Cu2+ + 2NO + 4H2O
Câu 21. Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,3 mol Fe và 0,3 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít
B. 1,6 lít
C. 0,8 lít
D. 1,2 lít
Lượng HNO3 tối thiểu cần dùng khi:
Fe → Fe2+ , Cu → Cu2+
Sơ đồ cho nhận e:
Fe – 2e → Fe2+
0,3 → 0,6
Cu – 2e → Cu2+
0,3 → 0,6
N+5 + 3e → N+2
3x x
Theo định luật bảo toàn mol e: 0,6 + 0,6 = 3x → x = 0,4 mol
Bảo toàn nguyên tố N: Số mol HNO3 = 0,6 + 0,6 + 0,4 = 1,6 mol
VHNO3 = 1,6 /1 = 1,6 lit
Câu 22.Phương trình điều chế HNO3 trong phòng thí nghiệm
A. 4NO2 + 2H2O + O2 → 4HNO3
B. N2O5 + H2O → 2HNO3
C. 2Cu(NO3)2 + 2H2O →2Cu + 4HNO3 + O2
D. NaNO3 (r) + H2SO4 đặc → HNO3 + NaHSO4
Để điều chế HNO3 trong phòng thí nghiệm người ta dùng NaNO3 và H2SO4đặc
H2SO4 + NaNO3 → NaHSO4+ HNO3
…………………………………
Mời các bạn tham khảo thêm tài liệu liên quan
Mầm Non Ánh Dương đã gửi tới bạn Cu+ HNO3 → Cu(NO3)2 + NO+ H2O được Mầm Non Ánh Dương biên soạn. Nội dung tài liệu gồm 5 phần, phần đầu giúp các bạn hoàn thành phương trình hóa học đã cho, các mục sau là bổ trợ, mở rộng cho phần cân bằng phản ứng hóa học.
Giúp các bạn biết cách viết và cân bằng phương trình phản ứng khi cho Cu tác dụng với HNO3, từ đó có thể nhận biết hiện tượng sau phản ứng. Cũng như mở rộng nội dung kiến thức, liên quan đến tính chất hóa học của axit nitric HNO3, tính chất hóa học của Al.
Các bạn có thể các em cùng tham khảo thêm một số tài liệu liên quan hữu ích trong quá trình học tập như: Giải bài tập Hóa 12, Giải bài tập Toán lớp 12, Giải bài tập Vật Lí 12,….
Ngoài ra, Mầm Non Ánh Dương đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Quyết tâm đỗ Đại Học Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức



