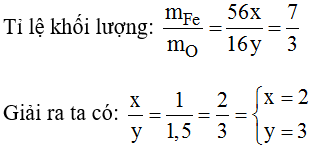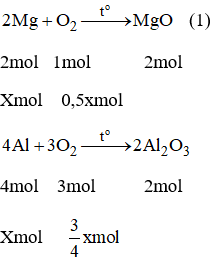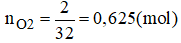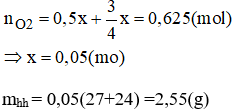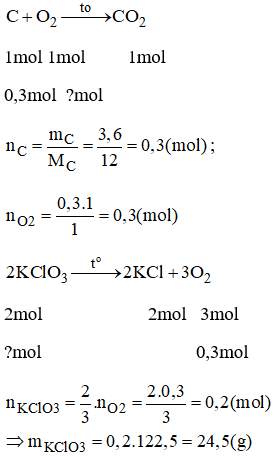Phản ứng 5O2 + 4P = 2P2O5 | Cân Bằng Phương Trình Hóa Học
O2 | oxi | khí + P | photpho | rắn = P2O5 | diphotpho penta oxit | rắn, Điều kiện Nhiệt độ nhiệt độ, Điều kiện khác dư oxi
5O2 + 4P → 2P2O5
5O2 + 4P → 2P2O5 là Phản ứng hoá hợpPhản ứng oxi-hoá khử, O2 (oxi) phản ứng với P (photpho) để tạo ra P2O5 (diphotpho penta oxit) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ Điều kiện khác: dư oxi
Điều kiện phản ứng để O2 (oxi) tác dụng P (photpho) là gì ?
Nhiệt độ: nhiệt độ Điều kiện khác: dư oxi
This post: 5O2 + 4P → 2P2O5
Làm cách nào để O2 (oxi) tác dụng P (photpho)?
Chúng mình không thông tin về làm thế nào để O2 (oxi) phản ứng với P (photpho) và tạo ra chất P2O5 (diphotpho penta oxit).
Bạn có thể kéo xuống dưới và click vào nút báo lỗi để đóng góp thông tin cho chúng mình nhé.
Nếu đang làm bài tập các bạn có thể viết đơn giản là O2 (oxi) tác dụng P (photpho) và tạo ra chất P2O5 (diphotpho penta oxit)
Hiện tượng nhận biết nếu phản ứng xảy ra 5O2 + 4P → 2P2O5 là gì ?
Photpho cháy mạnh trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong nước. Bột trắng đó là điphotpho pentaoxit và có công thức hoá học là P2O5
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 5O2 + 4P → 2P2O5
Nhiều phi kim tác dụng với oxi tạo thành oxit axit
Phương Trình Điều Chế Từ O2 Ra P2O5
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ O2 (oxi) ra P2O5 (diphotpho penta oxit)
Phương Trình Điều Chế Từ P Ra P2O5
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ P (photpho) ra P2O5 (diphotpho penta oxit)
Giải thích chi tiết về các phân loại của phương trình 5O2 + 4P → 2P2O5
Phản ứng hoá hợp là gì ?
Trong phản ứng hóa hợp, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi. Như vậy, phản ứng hóa hợp có thể là phản ứng oxi hóa – khử hoặc không phải là phản ứng oxi hóa – khử. Phản ứng hoá học là loại phản ứng xuất hiện nhiều trong chương trình Hoá trung học cơ sở, phổ thông cho tới Ôn Thi Đại Học.
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Bài tập vận dụng
Câu 1: Một oxit được tạo bởi 2 nguyên tố sắt và oxi trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Tìm công thức phân tử của oxit đó.
Gọi công thức hóa học của oxit sắt là: FexOy:
Công thức hóa học: Fe2O3.
Câu 2: Cho m gam hỗn hợp 2 kim loại Mg và Al có số mol bằng nhau phản ứng xảy ra hoàn toàn với lượng oxi dư. Kết thúc phản ứng thu được hỗn hợp chất rắn có khối lượng tăng so với hỗn hợp ban đầu là 2g. Tính m.
Đáp án :
Các PTHH của phản ứng:
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ mO2 = 2g.
Vì Mg và Al có số mol bằng nhau. Gọi nMg=nAl = x mol
Từ phương trình (1) và (2) ta có:
Câu 3: Khi đun nóng kali clorat KClO3 ( có chất xúc tác), chất này bị phân hủy tạo thành kali clorua và khí oxi.
Tính khối lượng kali clorua cần thiết để sinh ra một lượng oxi đủ đốt cháy hết 3,6g cacbon.
Đáp án :
Source: Mamnonanhduongvt.edu.vn
Category: Phương Trình Hoá Học Lớp 8