Phản ứng 2HgO = 2Hg + O2 | Cân Bằng Phương Trình Hóa Học
HgO | thủy ngân oxit | rắn = Hg | thủy ngân | lỏng + O2 | oxi | khí, Điều kiện Nhiệt độ 450 – 500
2HgO → 2Hg + O2
2HgO → 2Hg + O2 là Phản ứng phân huỷ Phản ứng oxi-hoá khử, HgO (thủy ngân oxit) để tạo ra Hg (thủy ngân), O2 (oxi) dười điều kiện phản ứng là Nhiệt độ: 450 – 500°C
Điều kiện phản ứng để HgO (thủy ngân oxit) là gì ?
Nhiệt độ: 450 – 500°C
This post: 2HgO → 2Hg + O2
Làm cách nào để HgO (thủy ngân oxit)?
Chúng mình không thông tin về làm thế nào để HgO (thủy ngân oxit) và tạo ra chất Hg (thủy ngân) phản ứng với O2 (oxi).
Bạn có thể kéo xuống dưới và click vào nút báo lỗi để đóng góp thông tin cho chúng mình nhé.
Nếu đang làm bài tập các bạn có thể viết đơn giản là HgO (thủy ngân oxit) và tạo ra chất Hg (thủy ngân), O2 (oxi)
Hiện tượng nhận biết nếu phản ứng xảy ra 2HgO → 2Hg + O2 là gì ?
Chất rắn màu đen Thủy ngân oxit (HgO) dần chuyển sang màu trắng bạc của Thủy ngân (Hg).
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 2HgO → 2Hg + O2
Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thông tin
Phương Trình Điều Chế Từ HgO Ra Hg
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HgO (thủy ngân oxit) ra Hg (thủy ngân)
Phương Trình Điều Chế Từ HgO Ra O2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HgO (thủy ngân oxit) ra O2 (oxi)
Giải thích chi tiết về các phân loại của phương trình 2HgO → 2Hg + O2
Phản ứng phân huỷ là gì ?
Trong phản ứng phân hủy, số oxi hóa cuả các nguyên tố có thể thay đổi hoặc không thay đổi. Như vậy, phản ứng phân hủy có thể là phản ứng oxi hóa – khử hoặc không phải là phản ứng oxi hóa – khử. Phản ứng hoá học là loại phản ứng xuất hiện nhiều trong chương trình Hoá trung học cơ sở, phổ thông cho tới Ôn Thi Đại Học.
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khử.
Bài tập vận dụng
Câu 1: Cho các phản ứng sau:
Cho phản ứng sau:
A. 2HgO →to2Hg + O2.
B. CaCO3 →toCaO + CO2.
C. 2Al(OH)3→toAl2O3 + 3H2O.
D. 2NaHCO3→toNa2CO3 + CO2 + H2O.
Phản ứng nào là phản ứng oxi hóa – khử.
Lời giải:
Phản ứng oxi hóa – khử là :
A. 2HgO –to→ 2Hg + O2.
Hg2+ + 2e → Hg0
2O2- → O2 + 4e
Câu 2: Cho các phản ứng sau:
A. 4NH3+ 5O2→ 4NO + 6H2O.
B. 2NH3+ 3Cl2→ N2 + 6HCl.
C. 2NH3+ 3CuO → 3Cu + N2+ 3H2O.
D. 2NH3+ H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
Ở phản ứng nào NH3 không đóng vai trò chất khử?
Lời giải:
Phản ứng NH3 không đóng vai trò chất khử.
2NH3+ H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
Do N không thay đổi số oxi hóa trước và sau phản ứng.
Câu 3: Phân biệt chất oxi hóa và sự oxi hóa, chất khử và sự khử. Lấy thí dụ để minh họa.
Lời giải:
Chất oxi hóa là chất nhận electron.
Sự oxi hóa 1 chất là làm cho chất đó nhường electron.
Chất khử là chất nhường electron.
Sự khử 1 chất là sự làm cho chất đó thu electron.
Thí dụ:
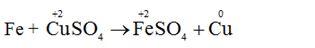
– Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự oxi hóa nguyên tử sắt.
– Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Source: Mamnonanhduongvt.edu.vn
Category: Phương Trình Hoá Học Lớp 8