Hoá 12 bài 10: Amino Axit tính chất hoá học, công thức cấu tạo và bài tập về Amino Axit. Amino axit là hợp chất hữu cơ có 2 nhóm chức đó là nhóm amino -NH2 và nhóm cacboxyl -COOH vì vậy mà Amino axit có đầy đủ tính chất hoá học của nhóm amino và nhóm cacboxyl.
Vậy tính chất hoá học cụ thể của amino axit là gì? Amino axit có công thức cấu tạo như thế nào, được ứng dụng vào lĩnh vực nào trong đời sống thực tế? chúng ta hãy cùng tìm hiểu qua bài viết dưới đây.
This post: Hoá 12 bài 10: Amino Axit tính chất hoá học, công thức cấu tạo và bài tập về Amino Axit
I. Amino Axit – Định nghĩa, Cấu tạo, danh pháp
1. Amino Axit là gì?
– Amino axit làlà những hợp chất hữu cơ tạp chức trong phân tử có chứa đồng thời 2 nhóm chức: nhóm amino (NH2) và nhóm cacboxyl (COOH).
– Công thức chung của amino axit: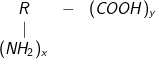
Ví dụ: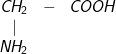 ;
;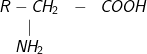 ;
;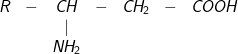
⇒Amino axit đơn giản nhất là: H2N-COOH
2. Công thức cấu tạo của Amino axit
– Trong phân tử amino axit, nhóm NH2và nhóm COOH tương tác với nhau tạo ion lưỡng cực. Vì vậy amino axit kết tinh tồn tại ở dạng ion lưỡng cực
– Trong dung dịch, dạng ion lưỡng cực chuyển một phần nhỏ thành dạng phân tử
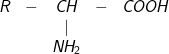
3. Cách gọi tên amino axit – danh pháp
a) Tên thay thế:
Axit + vị trí + amino + tên axit cacboxylic tương ứng.
Ví dụ: H2N–CH2–COOH: axit aminoetanoic ; HOOC–[CH2]2–CH(NH2)–COOH: axit 2-aminopentanđioic
b) Tên bán hệ thống:
Axit + vị trí chữ cái Hi Lạp (α, β, γ, δ, ε, ω) + amino + tên thông thường của axit cacboxylic tương ứng.
Ví dụ:CH3–CH(NH2)–COOH : axit α-aminopropionic
H2N–[CH2]5–COOH : axit ε-aminocaproic
H2N–[CH2]6–COOH: axit ω-aminoenantoic
c) Tên thông thường:
– Các amino axit thiên nhiên (α-amino axit) đều có tên thường.
Ví dụ: NH2-CH2-COOH: Axit aminoaxetic tên thường là glixin hay glicocol)
CH3-CH(NH2)-COOH : Axit aminopropionic (alanin)
HOOC-CH2-CH2-CH(NH2)-COOH : Axit α-aminoglutaric (axit glutamic)
(CH3)2CHCH(NH2)COOH : Axit α-aminoisovaleric (valin)
NH2(CH2)4CH(NH2)COOH: Axit α,ε-điaminocaproic (Lysin)
HO-C6H4-CH2-CH(NH2)-COOH : Axit α-amino-β (p-hidroxiphenyl) propanoic (tyrosin)
II. Tính chất vật lý của Amino Axit
– Chất rắn, dạng tinh thể, không màu, vị hơi ngọt.
– Nhiệt độ nóng chảy cao, dễ tan trong nước vì amino axit tồn tại ở dạng ion lưỡng cực:
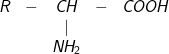
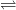
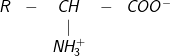
dạng phân tử dạng ion lưỡng cực
III. Tính chất hoá học của Amino Axit
1. Sự phân li trong dung dịch
–Sự phân ly trong dung dịch tạo ion lưỡng cực
H2N-CH2-COOH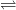 H3N+-CH2-COO–
H3N+-CH2-COO–
2. Aminoaxit có tính lưỡng tính
a) Tính axit của amino axit (amino axit + NaOH hoặc amino axit + KOH)
– Tác dụng với bazơ mạnh tạo ra muối và nước:
NH2-CH2-COOH + KOH →NH2-CH2-COOK + H2O
* Chú ý: để giải bài tập amino axit các em chú ý sử dụng phương pháp tăng giảm khối lượng.
b. Tính bazơ của amino axit (amino axit + HCl hoặc amino axit + H2SO4)
– Amino axit tác dụng với axit mạnh tạo muối.
NH2-CH2-COOH + HCl→ClNH3– CH2– COOH
NH2-CH2-COOH + HCl→ClNH3– CH2– COOH
* Chú ý: sử dụng phương pháp tăng giảm khối lượng và định luật bảo toàn khối lượng khi giải bài tập.
3. Phản ứng trùng ngưng của amino axit
nNH2-CH2-COOH→(- NH-CH2-CO-)n+ nH2O (H+)
– Phản ứng trùng ngưng của 6-aminohexanoic (axitε-aminocaproic) hoặc axit 7-aminoheptanoic (axitω-aminoenantoic) với xác tác tạo thành polime thuộc loại poliamit.
– Từ n aminoaxit khác nhau có thể tạo thành n! polipeptit chứa n gốc aminoaxit khác nhau; nnpolipeptit chứa n gốc aminoaxit.
4. Amino axit tác dụng với HNO2 (phản ứng của nhóm NH2)
HOOC-R-NH2+ HNO2→HOOC-R-OH + N2+ H2O
5. Amino axit phản ứng este hoá(phản ứng este hoá nhóm COOH)
NH2-CH2-COOH + ROH→NH2-CH2-COOR + H2O (khí HCl)
* Chú ý:Aminoaxit có làm đổi màu quỳ tím hay không tùy thuộc vào quan hệ giữa số nhóm COOH và số nhóm NH2có trong phân tử amino axit:
+ Nếu phân tử amino axit có số nhóm COOH = số nhóm NH2→amino axit không làm đổi màu quỳ tím.
+ Nếu phân tử amino axit có số nhóm COOH > số nhóm NH2→amino axit làm đổi màu quỳ tím thành đỏ.
+ Nếu phân tử amino axit có số nhóm COOH < số nhóm NH2→amino axit làm đổi màu quỳ tím thành xanh.
– Các phản ứng do muối của amino axit tác dụng với dung dịch axit hoặc dung dịch kiềm.
NH2-CH2-COOK + 2HCl→NH3Cl-CH2-COOH + KCl
NH3Cl-CH2-COOH + 2KOH→NH2-CH2-COOK + KCl + H2O
IV. Điều chế và ứng dụng của Amino Axit
1. Phương pháp điều chế Amino axit
– Thủy phân protit:
(-NH-CH2-CO-)n+ nH2O→nNH2-CH2-COOH
2. Ứng dụng của Amino axit
– Amino axit thiên nhiên (hầu hết làα – amino axit) là cơ sở để kiến tạo nên các loại protein của cơ thể sống.
– Một số amino axit được dùng phổ biến trong đời sống như muối mononatri của axit glutamic dùng làm gia vị thức ăn (gọi là mì chính hay bột ngọt); axit glutamic là thuốc hỗ trợ thần kinh, methionin là thuốc bổ gan.
– Axit 6-amino hexanoic và 7-amino heptanoiclà nguyên liệu để sản xuất tơ nilon-6và nilon-7.
V. Bài tập Amino Axit
Bài 1 trang 48 SGK hoá 12:Ứng với công thức phân tử C4H9NO2có bao nhiêu amino axit là đồng phân cấu tạo của nhau?
A. 3. B. 4. C. 5. D. 6.
* Lời giảiBài 1 trang 48 SGK hoá 12:
– Đáp án: C. 5
– Các đồng phân cấu tạo củaC4H9NO2
1. 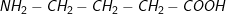
2. 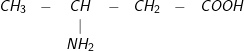
3. 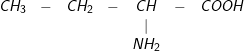
4. 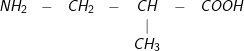
5. 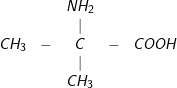
Bài 2 trang 48 SGK hóa 12:Có 3 chất hữu cơ: H2NCH2COOH, CH3CH2COOH, CH3[CH2]3NH2
Để nhận ra dung dịch của các chất trên chỉ cần dùng thuốc thử nào sau đây?
A. NaOH. B. HCl. C. CH3OH/HCl. D. Quỳ tím.
* Lời giảiBài 2 trang 48 SGK hóa 12:
– Đáp án: D.Quỳ tím.
– Cho quỳ tím vào 3 mẫu thử, mẫu thử nào quỳ tím có màu đỏ là CH3CH2COOH, mẫu thử nào quỳ tím có màu xanh là CH3[CH2]3NH2, mẫu thử mà quỳ tím không màu là H2NCH2COOH
Bài 3 trang 48 SGK hóa 12:Amino axit X có phần trăm khối lượng các nguyên tố C, H, N là 40,45%; 7,86%; 15,73%, còn lại là oxi, và công thức phân tử trùng với công thức đơn giản nhất. Xác định công thức cấu tạo và gọi tên của X.
* Lời giải Bài 3 trang 48 SGK hóa 12:
– Theo bài ra, ta có: %mO = 100% – (%mC –%mH–%mN)= 100% – (40,45% – 7,86% – 15,73%) = 35,96%
– Gọi công thức tổng quát của X là: CxHyOzNt
⇒ Ta có tỉ lệ: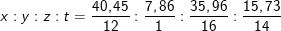
⇔ x : y : z : t = 3 : 7 : 2 : 1
⇒Công thức đơn giản : (C3H7O2N)n.
– Vì công thức phân tử trùng với công thức đơn giản nên công thức phân tử C3H7O2N
⇒ Công thức cấu tạo CH3-CH(NH2)-COOH Axit α-aminopropinoic (alanin)
Bài 4 trang 48 SGK hóa 12:Viết phương trình hóa học của các phản ứng giữa axit 2-aminopropanoic với NaOH, H2SO4; CH3OH khi có mặt khí HCl bão hòa.
* Lời giải Bài 4 trang 48 SGK hóa 12:
CH3-CH(NH2)-COOH + NaOH → CH3-CH(NH2)-COONa + H2O.
CH3-CH(NH2)-COOH + H2SO4→ CH3-CH(NH3HSO4)-COOH .
CH3-CH(NH2)-COOH + CH3OH → CH3-CH(NH2)-COOCH3+ H2O.
Bài 5 trang 48 SGK hóa 12:Viết phương trình hóa học phản ứng trùng ngưng các amino axit sau:
a) Axit 7 – aminoheptanoic
b) Axit 10- aminođecanoic
* Lời giảiBài 5 trang 48 SGK hóa 12:
– Axit 7-aminoheptanoic
nH2N – CH2 – (CH2)5 – COOH![small xrightarrow[]{t^{0},TN}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632566659yyujm91tkl_1632571219-1.gif) (-HN-CH2-(CH2)5-CO-)n
(-HN-CH2-(CH2)5-CO-)n
– Axit 10-aminođecanoic
nH2N – CH2– (CH2)8– COOH![small xrightarrow[]{t^{0},TN}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1632566659yyujm91tkl_1632571219-1.gif) (-HN-CH2-(CH2)8-CO-)n
(-HN-CH2-(CH2)8-CO-)n
Bài 6 trang 48 SGK hóa 12:Este A được điều chế từ amino axit B (chỉ chứa C, H, N, O) và ancol metylic. Tỉ khối hơi của A so với H2là 44,5. Đốt cháy hoàn toàn 8,9 gam este A thu được 13,2 gam CO2, 6,3 gam H2O và 1,12 lít N2(đo ở đktc). Xác định công thức phân tử và công thức cấu tạo của A và B.
* Lời giảiBài 6 trang 48 SGK hóa 12:
– Theo bài ra, ta có: d(A/H2)= 44,5 ⇔ MA/MH2= 44,5⇒ MA= 44,5. 2 = 89 (g).
– Cũng theo bài ra, ta có có:
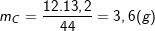 ;
;
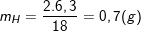 ;
;
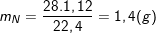 ;
;
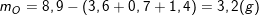
– Gọi công thức của A là CxHyOzNt, ta có tỉ lệ:
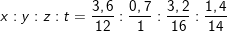
⇒ 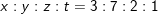
⇒Công thức phân tử có dạng (C3H7O2N)n
– Mặt khác, ta có M = 89.n = 89⇒ n = 1
⇒ Công thức phân tử C3H7O2N
⇒ A là este của rượu metylic nên có công thức cấu tạo là H2N-CH2-COOCH3
⇒ Công thức cấu tạo của B là H2N-CH2-COOH
Hy vọng với bài viết về tính chất hoá học của amino axit, công thức cấu tạo và bài tập về amino axit ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức





