H2S + Cl2 + H2O → H2SO4 + HCl là phương trình phản ứng oxi hóa khử khi sục H2S vào dung dịch nước Cl2, được Mầm Non Ánh Dương biên soạn tổng hợp hướng dẫn các bạn viết và cân bằng phản ứng một cách chi tiết. Mời các bạn tham khảo.
1. Phương trình phản ứng H2S tạo ra H2SO4
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
S-2 → S+6 + 8e
This post: H2S + Cl2 + H2O → H2SO4 + HCl
→ S-2 nhường e → chất khử.
Cl2 + 2e → 2Cl–.
→ Cl2 nhận e → chất oxi hóa
2. Điều kiện phản ứng H2S ra H2SO4
Nhiệt độ thường
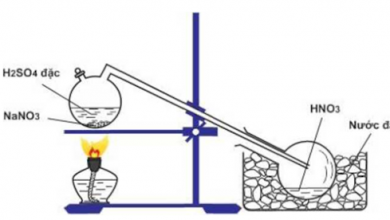
3. Cách tiến hành phản ứng H2S tạo ra H2SO4
Sục khí H2S vào dung dịch nước Clo
4. Tính chất hóa học của H2S
a. Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
b. Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,…mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
2H2S + 3O2 dư → 2H2O + 2SO2
2H2S + O2 → 2H2O + 2S
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
5. Bài tập vận dụng liên quan
Câu 1. Cho phản ứng hoá học sau: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào dưới đây phát biểu đúng:
A. H2S là chất oxi hoá, Cl2 là chất khử
B. H2S là chất khử, Cl2 là chất oxi hoá
C. H2S là chất khử, H2O là chất oxi hoá
D. H2S là chất oxi hoá, H2O là chất khử
Đáp án B
Câu 2. Cho phản ứng: H2S + Cl2 + H2O → H2SO4 + HCl
Tổng hệ số cân bằng trong phản ứng oxi hóa khử là:
A. 17
B. 18
C. 19
D. 20
Đáp án B
Câu 3.Tiến hành các thí nghiệm sau:
(a). Sục H2S vào dung dịch nước Clo
(b). Sục khí SO2 vào dung dịch KMnO4
(c). Cho H2S vào dung dịch Ba(OH)2
(d). Thêm H2SO4 loãng vào NaClO
(e). Đốt H2S trong oxi không khí.
(f). Sục khí Cl2 vào Ca(OH)2 huyền phù
Nhưng thí nghiệm nào xảy ra phản ứng oxi hoá – khử là
A. (a), (b), (e), (f)
B. (a), (c), (d), (e)
C. (a), (c), (d), (f)
D. (b), (d), (e), (f)
Đáp án A
(a). Sục H2S vào dung dịch nước Clo
(b). Sục khí SO2 vào dung dịch KMnO4
(e). Đốt H2S trong oxi không khí.
(f). Sục khí Cl2 vào Ca(OH)2 huyền phù
Câu 4.Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước brom
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước brom
Đáp án B
A. H2S, O2, nước brom.
Sai vì H2S thể hiện tính khử
B. O2, nước brom, dung dịch KMnO4.
Đúng vì SO2 là chất khử ( có số OXH tăng từ +4 lên +6)
C. Dung dịch NaOH, O2, dung dịch KMnO4.
Sai.Vì NaOH không thể tính tính oxh hoặc khử khi tác dụng với SO2
D. Dung dịch BaCl2, H2S, nước brom.
Sai.Vì có BaCl2
Câu 5.Dẫn 8,96 lít (đktc) hỗn hợp khí A gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong A là
A. 25%
B. 50%
C. 60%
D. 75%
Đáp án A
nhh A = 0,4 mol
nPbS = 0,1 mol
Phương trình phản ứng
H2S + Pb(NO3)2 → PbS + 2HNO3
0,1← 0,1
%VH2S = 25%
……………………………….
Trên đây Mầm Non Ánh Dương đã đưa ra nội dung chi tiết phương trình phản ứng khi sục khí H2S vào dung dịch Cl2: H2S + Cl2 + H2O → H2SO4 + HCl tới các bạn. Hy vọng các bạn học sinh nắm được nội dung từ đó áp dụng giải các dạng bài tập câu hỏi tương tự.
Để có kết quả học tập tốt và hiệu quả hơn, Mầm Non Ánh Dương xin giới thiệu tới các bạn học sinh tài liệu các môn Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà Mầm Non Ánh Dương tổng hợp biên soạn và đăng tải.
Ngoài ra, Mầm Non Ánh Dương đã thành lập group chia sẻ tài liệu học tập cũng như các bài giảng hay về lớp 10 miễn phí trên Facebook, mời bạn đọc cùng quý thầy cô tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)