Tính chất hóa học của lưu huỳnh, điều chế, ứng dụng lưu huỳnh
Như các em đã biết thì lưu huỳnh có hai dạng thù hình là lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ), hai dạng này có cấu tạo tinh thể và một số tính chất vật lý khác nhau nhưng tính chất hóa học thì lại giống nhau. Để hiểu rõ hơn về tính chất hóa học của lưu huỳnh cũng như tầm quan trọng của lưu huỳnh trong cuộc sống chúng ta sẽ tìm hiểu bài học sau đây.

This post: Tính chất hóa học của lưu huỳnh, điều chế, ứng dụng lưu huỳnh
Nội dung chính
Tìm hiểu về lưu huỳnh
Tính chất hóa học của lưu huỳnh
Cũng giống như một vài nguyên tố khác, lưu huỳnh vừa có tính oxi hóa vừa có tính khử và trong hợp chất lưu huỳnh có số oxi hóa là -2, 0, +4, +6
Lưu huỳnh tác dụng với kim loại và hiđro
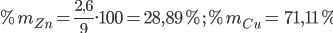
Ở nhiệt độ cao, lưu huỳnh phản ứng được với nhiều kim loại tạo ra muối sunfua, và lưu huỳnh phản ứng với hiđro tạo ra khí hiđrosunfua. Trong hai trường hợp này lưu huỳnh đều thể hiện tính oxi hóa từ 0 về -2
Lưu huỳnh tác dụng với phi kim
Lưu huỳnh tác dụng được với hầu hết các phi kim, ngoại trừ Nito và Iot
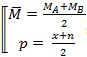
Ở nhiệt độ thích hợp, lưu huỳnh phản ứng được với một số phi kim mạnh hơn, lúc này lưu huỳnh thể hiện tính khử từ 0 lên +6s
Tác dụng với hợp chất
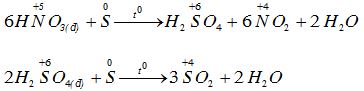
Lưu huỳnh thể hiện tính khử từ 0 lên +4, +6 khi tác dụng với các axit có tính oxi hóa.
Lưu ý: Lưu huỳnh không phản ứng với HCl, H2SO4 loãng
Kết luận:
– Khi tác dụng với các chất khử mạnh (kim loại, hiđro, cacbon), lưu huỳnh thể hiện tính oxi hóa. Và ngược lại khi tác dụng với các chất oxi hóa mạnh (phi kim mạnh hơn và axit có tính oxi hóa), lưu huỳnh thể hiện tính oxi hóa
– Ngoài tính khử và tính oxi hóa, lưu huỳnh còn thể hiện tính tự oxi hóa khử
3S + 6KOH → 2K2S + K2SO3 + 3H2O
Ứng dụng và cách điều chế lưu huỳnh
Ứng dụng của Lưu huỳnh
Lưu huỳnh được ứng dụng rộng rãi trong các ngành công nghiệp như:
– Lưu huỳnh trong tự nhiên được tồn tại dưới dạng hợp chất như trong các quặng, trong các mỏ lưu huỳnh, trong cơ thể động thực vật và 90% lượng lưu huỳnh khai thác được dùng để sản xuất H2SO4.
– 10% lượng lưu huỳnh còn lại được dùng để:
+ Lưu hóa cao su;
+ Chế tạo thuốc súng, công nghiệp diêm
+ Trừ sâu, chế mỡ, chữa bệnh ngoài da,…
Mở rộng: S còn là 1 nguyên tố vi lượng cần thiết cho sự sống, S là thành phần của phân bón cho công nghiệp… Ngoài ra, S cùng với C, KNO3 với tỉ lệ thích hợp được dùng để sản xuất ra thuốc súng đen. Phương trình phản ứng:
S + 3C + 2KNO3 → K2S + 3CO2 + N2
Điều chế lưu huỳnh
Như đã nói ở trên thì lưu huỳnh trong tự nhiên gồm 2 dạng cơ bản sau:
Đơn chất: Lưu huỳnh có trong các mỏ lưu huỳnh và các mỏ này chủ yếu gần các miệng núi lửa, suối nước nóng…
Hợp chất: muối sunfat, muối sunfua,… như Na2SO4.10H2O; CaSO4.2H2O (thạch cao); MgSO4.7H2O (muối chát)
Khi khai thác lưu huỳnh từ các mỏ: người ta dùng thiết bị đặc biệt để nén nước siêu nóng (1700C) vào mỏ làm lưu huỳnh nóng chảy và đẩy lên mặt đất. Sau đó lưu huỳnh được tách ra khỏi các tạp chất.
Phương trình phản ứng:
2H2S + O2(thiếu) → H2O + 2S
2H2S + SO2 → 2H2O + 3S
Ngoài ra S còn tồn tại ở dạng hợp chất, do đó người ta còn sản xuất lưu huỳnh từ các hợp chất chứa S như H2S, SO2 bằng cách:
+ Đốt H2S trong điều kiện thiếu oxi.
+ Dùng H2S để khử SO2.
So sánh tính chất hóa học của Oxi và lưu huỳnh
Lưu hình và oxi có những điểm giống và khác nhau. Hãy xem bảng bên dưới để hiểu hơn về tính chất hóa học của 2 chất này.
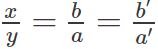
Bài tập trắc nghiệm
Câu 1: Chọn phát biểu đúng bên dưới.
A. H2S chỉ có tính khử. B. S chỉ có tính oxi hóa.
C. SO2 vừa có tính oxi hóa, vừa có tính khử. D. SO3 vừa có tính oxi hóa, vừa có tính khử.
Câu 2: S thể hiện tính khử khi tác dụng với
A. HNO3 đặc B. KClO3 C. Fe hoặc H2 D. HNO3 đặc hoặc KClO3
Câu 3: SO2 thể hiện tính khử khi phản ứng với
A. CaO, Mg B. Br2, O2 C. H2S, KMnO4 D. H2O, NaOH
Câu 4: Cho sơ đồ phản ứng: FeS2 → X → SO2. Chất X là
A. H2S B. Fe2(SO4)3 C. SO3 D. Na2SO3
Câu 5: Cho sơ đồ FeS2 ® A ® H2SO4. Chất A là
A. H2S B. SO2 C. SO3 D. SO2 hoặc H2S
Câu 6: Cho 0,2 mol khí SO2 tác dụng cùng với dung dịch chứa 0,3 mol NaOH sẽ thu được gì? Chọn đáp án đúng nhất:
A. 0,2 mol Na2SO3 B. 0,2 mol NaHSO3
C. 0,15 mol Na2SO3 D. Na2SO3 và NaHSO3 đều 0,1 mol
Câu 7: Cho SO3 dư qua dung dịch Ba(OH)2 thu được muối
A. BaSO3 B. BaSO4 C. Ba(HSO4)2 D. Ba(HSO3)2
Câu 8: Trong hợp chất, lưu huỳnh có các số oxi hóa nào sau đây?
A. 0, +4, +6 B. 0, -2, +6 C. -1, -2, +4 (D). -2, +4, +6
Câu 9: Ở trạng thái cơ bản, lưu huỳnh có số e độc thân là:
A. 0 B. 2 C. 4 D. 6
Câu 10: Điều nhận xét nào bên dưới là không đúng về lưu huỳnh:
A. Có 2 dạng thù hình B. vừa có tính oxi hóa và khử
C. điều kiện thường: thể rắn D. dễ tan trong nước.
Đáp án:
| Câu 1: | Câu 2: | Câu 3: | Câu 4: | Câu 5: | Câu 6: | Câu 7: | Câu 8: | Câu 9: | Câu 10: |
| A | A | B | D | C | A | B | D | B |
D |
Trong phần điều chế lưu huỳnh bằng phương pháp sản xuất S từ H2S và SO2, có thể các em chưa biết nhờ Phương pháp này mà người ta đã thu hồi được khoảng trên 90% lượng S có trong các khí thải độc hại SO2 và H2S. Sau khi được tìm hiểu về tính chất hóa học của lưu huỳnh chúng ta có được thêm những kiến thức mở rộng thú vị và bổ ích, qua đó các em có thể áp dụng những kiến thức này trong những thí nghiệm hay những bài kiểm tra nhỏ. Chúc các em học tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





