Tính chất hoá học của Cacbon (C), Cacbon oxit (CO). Cacbon (C) là một trong những phi kim có nhiều ứng dụng trong đời sống, cacbon có ký hiệu hoá học là C và nguyên tử khối là 12
Cacbon (C) được ứng dụng làm than chì làm điện cực, chất bôi trơn, ruột bút chì. Kim cương được dùng làm đồ trang sức, mũi khoan, dao cắt kính. Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi. Than đá, than gỗ, được dùng làm nhiên liệu, làm chất khử để điều chế một số kim loại.
This post: Tính chất hoá học của Cacbon (C), Cacbon oxit (CO) – hoá lớp 9
Như vậy Cacbon có rất nhiều ứng dụng, trong bài viết này chúng ta cùng tìm hiểu Cacbon có các tính chất vật lý và hoá học gì các bạn nhé.
 I. Tính chất hấp thụ của Cacbon (C)
I. Tính chất hấp thụ của Cacbon (C)
- Than gỗ có tính hấp phụ chất màu tan trong dung dịch.
- Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, chất hơi.
- Than gỗ có tính hấp phụ Than gỗ, than xương … mới được điều chế có tính hấp phụ cao được gọi là than hoạt tính.
- Than hoạt tính được dùng để làm trắng đường, chế tạo mặt nạ phòng độc…
II. Tính chất hoá học của Cacbon (C)
1. Cacbon tác dụng với oxi
C + O2 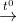 CO2
CO2
2. Cacbon tác dụng với oxit kim loại
2CuO + C 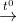 CO2 + 2Cu
CO2 + 2Cu
– Ngoài ra ở nhiệt độ cao, Cacbon có thể khử một số oxit kim loại như PbO, ZnO,… thành kim loại Pb, Zn,…
III. Tính chất hoá học của Cacbon oxit (CO)
1. Tính chất vật lí của Cacbon oxit (CO)
CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí (dCO/kk = 28/29), rất độc.
2. Tính chất hóa học của Cacbon oxit (CO)
a) CO là oxit trung tính
– Ở điều kiện thường CO không phản ứng với nước, axit, bazơ.
b) CO là chất khử
– Ở nhiệt độ cao, CO khử được nhiều oxit kim loại
CO + CuO → CO2 + Cu
2CO + Fe3O4 → 3Fe + 2CO2
2CO + O2 → 2CO2
IV. Tính chất hoá học của Cacbon đioxit (CO2)
1. Tính chất vật lí của cacbon đioxit (CO2)
– CO2 là khí không màu, không mùi, nặng hơn không khí (dCO2/kk = 44/29).
– Người ta có thể rót khí CO2 từ cốc này sang cốc khác. CO2 không duy trì sự sống và sự cháy. CO2 bị nén và làm lạnh thì hóa rắn, được gọi là nước đá khô (tuyết cacbonic). Người ta dùng nước đá khô để bảo quản thực phẩm.
2. Tính chất hóa học của cacbon đioxit (CO2)
a) Cacbon đioxit tác dụng với nước
CO2(k) + H2O (dd) = H2CO3 (dd)
b) Cacbon đioxit tác dụng với dung dịch bazơ
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
– Tùy thuộc vào tỉ lệ giữa số mol CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay cả 2 muối.
c) Cacbon đioxit tác dụng với oxit bazơ
CO2 + CaO → CaCO3
– Như vậy, CO2 có tính chất của một oxit axit.
V. Bài tập về cacbon, cacbon oxit và cacbon đioxit
Bài 2 trang 84 sgk hoá 9: Viết phương trình hóa học của cacbon với các oxit sau:
a) CuO. b) PbO. c) CO2. d) FeO.
Lời giải: Trong các phản ứng dưới đây cacbon là chất khử.
a) 2CuO + C 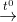 2Cu + CO2
2Cu + CO2
b) 2PbO + C 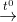 2Pb + CO2
2Pb + CO2
c) CO2 + C 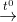 2CO
2CO
d) 2FeO + C 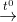 2Fe + CO2
2Fe + CO2
* Ứng dụng của cacbon:
+ Tùy thuộc vào tính chất mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất, kĩ thuật.
– Ví dụ: Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì. Kim cương dùng làm đồ trang sức, mũi khoan, sao cắt hình.
– Than đá, than gỗ được dùng làm nhiên liệu trong công nghiệp, chất khử để điều chế một số kim loại kém hoạt động.
Bài 2 trang 87 sgk hoá 9: Hãy viết phương trình hóa học của CO2 với dung dịch NaOH, dung dịch Ca(OH)2 trong trường hợp
a) Tỉ lệ số mol n : n = 1 : 1
b) Tỉ lệ số mol n : n = 2 : 1
Lời giải: Phương trình hóa học của CO2 với:
a) Dung dịch NaOH theo tỉ lệ nCO2 : nNaOH = 1 : 1
CO2 + NaOH → NaHCO3
b) Dung dịch Ca(OH)2 theo tỉ lệ nCO2 : nCa(OH)2 = 2 : 1.
2CO2 + Ca(OH)2 → Ca(HCO3)2↓
Bài 5 trang 87 sgk hoá 9: Hãy xác định thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp CO và CO2, biết các số liệu thực nghiệm sau:
– Dẫn 16 lít hỗn hợp CO và CO2 qua nước vôi trong dư thu được khí A.
– Để đốt cháy A cần 2 lít khí oxi. Các thể tích khí đo được ở cùng điều kiện nhiệt độ và áp suất.
Lời giải:
– Dẫn hỗn hợp khí CO và CO2 qua nước vôi trong dư, khí CO2 bị hấp thụ hoàn toàn, khí A thu được là khí CO. Trong cùng điều kiện về nhiệt độ, áp suất thì tỉ lệ thể tích cũng bằng tỉ lệ về số mol.
– Phương trình phản ứng đốt cháy khí A bằng 2 lít khí oxi:
2CO + O2 → 2CO2.
– Từ PTPƯ trên ta nhận thấy: nCO = 2.nO2
⇒ VCO = 2.VO2 = 2.2 = 4 lít. (tỉ lệ mol cũng chính là tỉ lệ thể tích)
⇒ VCO2 = 16 – 4 = 12 lít.
⇒ % VCO2 = (12/16).100% = 75 %;
⇒ %VCO = 100% – 75% = 25%.
Hy vọng với phần hệ thống lại kiến thức về tính chất hoá học của Cacbon (C), Cacbon oxit CO và Cacbon đioxit CO2 ở trên sẽ giúp ích cho các em. Hãy like và chia sẻ nếu thấy có ích, mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được giải đáp. Chúc các em học tốt!
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục