Hóa 12 bài 36: Sơ lược tính chất hóa học của Niken (Ni), Kẽm (Zn), Chì (Pb), Thiếc (Sn). Các kim loại như Niken (Ni) Kẽm (Zn) Chì (Pb) Thiếc (Sn) có tính chất hóa học gì mà chúng cũng có một số ứng dụng trong thực tế nhưng không nhiều bằng Nhôm Sắt và Đồng
Trong bài viết này chúng ta cùng tìm hiểu sơ lược về Niken (Ni) Kẽm (Zn) Chì (Pb) Thiếc (Sn), chúng có tính chất hóa học và tính chất vật lý như thế nào và có ứng dụng gì trong đời sống sản xuất.
This post: Hóa 12 bài 36: Sơ lược tính chất hóa học của Niken (Ni), Kẽm (Zn), Chì (Pb), Thiếc (Sn)
I. Tính chất Niken – Ni
1. Vị trí của Niken (Ni) trong bảng HTTH
– Thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28
– Cấu hình electron nguyên tử: [Ar]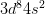 .
.
2. Tính chất vật lý của Niken
– Niken là kim loại có màu trắng bạc, rất cứng, khối lượng riêng lớn D = 8,9g/cm3, t0nc = 14550C
3. Tính chất hóa học của Niken
– Thường có số oxi hóa +2 trong các hợp chất.
– Có tính khử yếu: tác dụng với phi kim ở nhiệt độ cao, tác dụng với dung dịch axit, tác dụng với dung dịch muối, bền với nước và không khí ở nhiệt độ thường.
a) Niken tác dụng với phi kim
– Khi đun nóng, Ni phản ứng được một số phi kim (như oxi, clo,…)
* Ví dụ:
Niken tác dụng với oxi: 2Ni + O2 ![small xrightarrow[]{500^{0}C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrow500_1550675736.gif) 2NiO
2NiO
Niken tác dụng với brom: Ni + Br2 → NiBr2
Niken tác dụng với Clo: Ni + Cl2 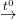 NiBr2
NiBr2
b) Niken tác dụng với axit
– Niken tác dụng với axit HCl và H2SO4 loãng giải phóng khí hidro.
Ni + 2HCl (loãng) → NiCl2 + H2↑
– Niken tan dễ dàng trong dung dịch axit HNO3 đặc, nóng.
Ni + 4HNO3 (đặc,nóng) → Ni(NO3)2 + 2NO2↑ + 2H2O.
4. Ứng dụng của Niken
– Ni được dùng mạ lên sắt để làm đẹp, chống gỉ và còn được dùng làm chất xúc tác.
II. Tính chất của Kẽm – Zn
1. Vị trí của Kẽm (Zn) trong bảng HTTH
– Thuộc nhóm IIB, chu kì 4, số hiệu nguyên tử là 30.
– Cấu hình electron nguyên tử: [Ar]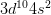 .
.
2. Tính chất vật lý của Kẽm
– Kẽm là kim loại có màu lam nhạt, trong không khí ẩm, kẽm bị phủ 1 lớp màng oxit mỏng nên có màu xám. Kẽm là kim loại có khối lượng riêng lớn D = 7,13g/cm3, t0nc = 14550C.
– Kẽm giòn ở nhiệt độ thường, nhưng khi đun nóng tới 100 – 1500C lại dẻo và dai, đến 2000C thì giòn trở lại.
– Ở trạng thái rắn, kẽm và các hợp chất của kẽm không độc. Riêng hơi của ZnO rất độc.
3. Tính chất hóa học của Kẽm
– Thường có số oxi hóa +2 trong các hợp chất.
– Có tính khử mạnh hơn sắt: tác dụng với phi kim ở nhiệt độ cao, tác dụng với dung dịch muối và axit, bền với nước và không khí ở nhiệt độ thường.
a) Kẽm tác dụng với phi kim
– Zn tác dụng trực tiếp với nhiều phi kim.
* Ví dụ:
Kẽm tác dụng với oxi: 2Zn + O2 → 2ZnO
Kẽm tác dụng với Clo: Zn + Cl2 → ZnCl2
– Ở điều kiện thường, Zn bị oxi hóa trong không khí hình thành lớp oxit bền bảo vệ ngăn không cho phản ứng tiếp tục xảy ra.
b) Kẽm tác dụng với axit
– Kẽm tác dụng với các dung dịch axit HCl, H2SO4loãng:
* Ví dụ: Zn + 2HCl → ZnCl2 + H2↑
PT ion: Zn + 2H+ → Zn2+ + H2↑
(Zn khử ion H+ trong dung dịch axit thành hidro tự do).
– Kẽm tác dụng với dung dịch HNO3, H2SO4 đặc: Với các axit HNO3 đặc nóng, HNO3 loãng, H2SO4 đặc: Zn khử được N+5 và S+6 xuống những mức oxi hoá thấp hơn.
Zn + 4HNO3 (đặc) → Zn(NO3)2 + 2NO2↑ + 2H2O
c) Kẽm tác dụng với H2O
– Do EoZn2+/Zn < Eo H2O/H2 (Zn khử được nước).
– Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
d) Kẽm tác dụng với bazơ
– Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2,…
* Ví dụ: Cho Zn vào dung dịch NaOH
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
4. Ứng dụng của Kẽm
– Zn được mạ lên tôn để chống gỉ và còn được dùng làm pin khô.
III. Tính chất của Chì – Pb
1. Vị trí của Chì (Pb) trong bảng HTTH
– Thuộc nhóm IVA, chu kì 6, số hiệu nguyên tử là 82.
– Cấu hình electron nguyên tử: [Xe]4f145d106s26p2.
2. Tính chất vật lý của Chì
– Chì là kim loại màu trắng hơi xanh, có khối lượng riêng lớn D = 11,34g/cm3, t0nc = 327,40C, chì mềm nên dễ dát thành lá mỏng.
3. Tính chất hóa học của Chì
– Thường có số oxi hóa +2 và +4 nhưng số oxi hóa +2 phổ biến và bền hơn.
– Có tính khử yếu: tác dụng với phi kim ở nhiệt độ cao, không tác dụng với các dung dịch HCl, H2SO4 loãng do PbCl2↓ và PbSO4↓ , tan được trong dung dịch HNO3 và H2SO4 đặc nóng do tạo muối tan Pb(HSO4)2 , tác dụng được với dung dịch muối, bền với nước và không khí ở nhiệt độ thường, tan chậm trong dung dịch kiềm nóng.
a) Chì tác dụng với phi kim
* Ví dụ: Pb + F2 → PbF2
Pb + O2 → PbO
– Chì kim loại chỉ bị oxi hóa ở bề ngoài trong không khí tạo thành một lớp chì oxít mỏng, chính lớp oxít này lại là lớp bảo vệ chì không bị oxi hóa tiếp.
b) Chì tác dụng với axit
– Chì không tác dụng với dung dịch HCl và H2SO4 loãng do các muối chì không tan bao bọc bên ngoài kim loại.
– Chì tan nhanh trong dung dịch H2SO4 đặc nóng và tạo thành muối tan là Pb (HSO4)2.
Pb + 3H2SO4 → Pb(HSO4)2 + SO2 + 2H2O.
– Chì dễ dàng tan trong dung dịch HNO3, tan chậm trong HNO3 đặc.
3Pb + 8HNO3 (loãng, nóng) → 3Pb(NO3)2 + 2NO + 4H2O.
c) Chì tác dụng với dung dịch kiềm
– Chì cũng tan chậm trong dung dịch kiềm nóng.
Pb + 2NaOH (đặc) + 2H2O → Na2[Pb(OH)4] + H2↑
4. Ứng dụng của Chì
– Được dùng để chế tạo bản cực ác quy, đầu đạn và chế tạo thiết bị chống tia phóng xạ.
IV. Tính chất của Thiếc – Sn
1. Vị trí của Thiếc (Sn) trong bảng HTTH
– Thuộc nhóm IVA, chu kì 5, số hiệu nguyên tử là 50.
– Cấu hình electron nguyên tử: [Kr]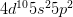 .
.
2. Tính chất vật lý của Thiếc
– Thiếc là kim loại màu trắng bạc, có khối lượng riêng lớn D = 7,92g/cm3 , t0nc = 2320C mềm và dễ dát mỏng.
3. Tính chất hóa học của Thiếc
– Thường có số oxi hóa +2 và +4 trong các hợp chất.
– Có tính khử yếu hơn Ni: tác dụng với phi kim ở nhiệt độ cao, tác dụng chậm với dung dịch axit (HNO3 loãng: Sn → Sn2+; H2SO4, HNO3 đặc: Sn → Sn4+), tác dụng với dung dịch muối, bền với nước và không khí ở nhiệt độ thường, bị hòa tan trong dung dịch kiềm đặc.
a) Thiếc tác dụng với phi kim
– Thiếc tác dụng với oxi: ở điều kiện thường trong không khí, Sn không bị oxi hóa. Ở nhiệt độ cao, Sn bị oxi hóa thành SnO2.
Sn + O2 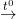 SnO2 .
SnO2 .
– Thiếc tác dụng với halogen.
* Ví dụ: Sn + 2Cl2 → SnCl4
b) Thiếc tác dụng với axit
– Thiếc tác dụng chậm với với dung dịch HCl và H2SO4loãng tạo thành muối Sn (II) và hidro.
Sn + H2SO4 → SnSO4 + H2↑
– Với H2SO4 và HNO3 đặc tạo thanh hợp chất Sn (IV)
Sn + 2H2SO4 (đặc) → SnO2 + 2SO2↑ + 2H2O.
Sn + 4HNO3 (đặc) → SnO2 + 4NO2↑ + 2H2O.
4Sn + 10HNO3 (rất loãng) → 4Sn(NO3)2 + NH4NO3 + 3H2O
b) Thiếc tác dụng với dung dịch kiềm đặc
Sn + NaOH (đặc, nguội) + 2H2O → Na[Sn(OH)3 ] + H2↑
Sn + 2NaOH (đặc) + 4H2O → Na2 [Sn(OH)6] + 2H2↑
4. Ứng dụng của Thiếc
– Sn được mạ lên sắt tây để chống gỉ và được dùng làm thiếc hàn.
V. Bài tập ôn tập Niken, Kẽm, Thiếc, Chì
Bài 1 trang 163 SGK Hóa 12: Dãy nào sắp xếp theo thứ tự tính khử tăng dần
A. Pb, Ni, Sn, Zn
B. Pb, Sn, Ni, Zn
C. Ni, Sn, Zn, Pb
D. Ni, Zn, Pb, Sn
* Lời giải bài 1 trang 163 SGK Hóa 12:
- Đáp án: B. Pb, Sn, Ni, Zn
Bài 2 trang 163 SGK Hóa 12: Sắt tây là sắt được phủ lên bề mặt bởi kim loại nào sau đây?
A. Zn. B. Ni. C. Sn. D. Cr.
* Lời giải bài 2 trang 163 SGK Hóa 12:
- Đáp án: C. Sn
Bài 3 trang 163 SGK Hóa 12: Cho 32 gam hỗn hợp gồm MgO, Fe2O3 và CuO tác dụng vừa đủ với 300 ml dung dịch H2SO4 2M. Khối lượng muối thu được là :
A. 60 gam. B. 80 gam.
C. 85 gam. D. 90 gam.
* Lời giải bài 3 trang 163 SGK Hóa 12:
- Đáp án: B. 80 gam.
* Cách 1:
– Các phương trình hoá học của phản ứng:
MgO + H2SO4 → MgSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
CuO + H2SO4 → CuSO4 + H2O
– Theo bài ra, ta có: nH2SO4 = 0,3.2 = 0,6 (mol).
– Theo PTPƯ, 1 mol oxit phản ứng tạo thành 1 mol muối
⇒ khối lượng tăng (do gốc SO42- thay oxi tạo muối) : mSO4 – mO = 96 – 16 = 80 (g).
⇒ mmuối = 32 + 80.0,6 = 80 (g).
* Cách 2:
– Gọi công thức chung của tất cả các oxit là M2Ox
– Phương trình hoá học của phản ứng:
M2Ox + xH2SO4 → M2(SO4)x + xH2O
– Theo bài ra, nH2SO4 = 0,3.2 = 0,6 (mol).
– Theo PTPƯ ⇒ nO (trong oxit) = nH2SO4 = 0,6 (mol).
⇒ mKim loại = mhh – mO = 32 – 0,6.16 = 22,4 (g).
⇒ mmuối = mKim loại + mSO42- = 22,4 + 0,6.96 = 80(g).
Bài 4 trang 163 SGK Hóa 12: Hợp chất nào sau đây không có tính chất lưỡng tính ?
A. ZnO B. Zn(OH)2
C. ZnSO4 D. Zn(HCO3)2
* Lời giải bài 4 trang 163 SGK Hóa 12:
- Đáp án: C. ZnSO4
– Lưu ý: Chất lưỡng tính là chất vừa tác dụng được với axit vừa tác dụng được với bazơ
Bài 5 trang 163 SGK Hóa 12: Cho dung dịch NaOH vào dung dịch muối sunfat của kim loại hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Đó là muối nào sau đây?
A. MgSO4 B. CaSO4
C. MnSO4 D. ZnSO4
* Lời giải bài 5 trang 163 SGK Hóa 12:
- Đáp án: D. ZnSO4
– Phương trình hoá học của phản ứng:
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2↓
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Hy vọng với bài viết sơ lược về tính chất hoá học của Niken (Ni), Kẽm (Zn), Chì (Pb), Thiếc (Sn), ứng dụng của các kim loại này và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết để Mầm Non Ánh Dương ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục





