Hoá 11 bài 15: Tính chất hoá học của Cacbon (C), bài tập về cacbon. Cacbon (C) ở dạng hợp chất có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3).
Ngoài ra, Cacbon (C) còn có dạng đơn chất như Kim cương, than chì và Fuleren. Trong bài viết này chúng ta cùng tìm hiểu về tính chất hoá học của Cacbon, ứng dụng của Cacbon và vận dụng giải các bài tập về cacbon.
This post: Hoá 11 bài 15: Tính chất hoá học của Cacbon (C), bài tập về cacbon
* Sơ lược về nguyên tử cacbon
- Ký hiệu hoá học: C
- Khối lượng nguyên tử: 12
- Vị trí trong bảng HTTT: ô thứ 6 nhóm IVA chu kỳ 2
- Cấu hình electron: 1s22s22p2
I. Tính chất vật lý của Cacbon – C
– C có nhiều dạng thù hình: kim cương, than chì và C vô định hình, fuleren.
– Cấu trúc của tinh thể kim cương, tinh thể than chì và fuleren như hình sau:
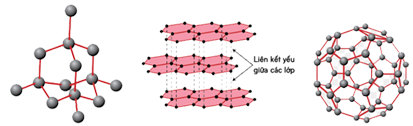
1. Kim cương
– Là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém.
– Có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
2. Than chì
– Là chất tinh thể màu xám đen.
– Tinh thể than chì có cấu trúc lớp nên mềm.
3. Fuleren
– Fuleren gồm các phân tử C60, C70, … Phân tử C60 có cấu trúc hình cầu rỗng, gồm 32 mặt, với 60 đỉnh là 60 nguyên tử cacbon..
4. Cacbon vô định hình
– Điều chế nhân tạo như than gỗ, than xương, than muội, … có cấu tạo xốp nên hấp phụ mạnh các chất khí và chất tan trong dung dịch.
II. Tính chất hoá học của Cacbon – C
– C có thể tồn tại với nhiều mức oxi hóa khác nhau nhưng thường gặp là: -4; 0; +2; +4.
– C có cả tính khử và tính oxi hoá nhưng tính khử vẫn là chủ yếu.
1. Cacbon là chất khử
a) Cacbon tác dụng với các phi kim:
C + O2 → CO2
C + CO2 ![small xrightarrow[]{400^{0}C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrow400_1548835394.gif) 2CO
2CO
b) Cacbon tác dụng với oxit kim loại:
+ Cacbon khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) Cu + CO
Cu + CO
Fe2O3 + 3C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) 2Fe + 3CO
2Fe + 3CO
c) Cacbon tác dụng với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (20000C)
d) Cacbon tác dụng với các chất oxi hóa mạnh
– Thường gặp là H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7… trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) CO2 + 2SO2↑ + 2H2O
CO2 + 2SO2↑ + 2H2O
C + 4HNO3 đặc ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) CO2 + 4NO2↑ + 2H2O
CO2 + 4NO2↑ + 2H2O
C + 4KNO3 ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) 2K2O + CO2↑ + 4NO2
2K2O + CO2↑ + 4NO2
e) Cacbon tác dụng với hơi nước (khi nhiệt độ cao)
C + H2O ![small small xrightarrow[]{1000^{0}C}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1548835404wnow462gkw.gif) CO + H2↑
CO + H2↑
C + 2H2O → CO2 + 2H2↑
2. Cacbon là chất oxi hóa
a) Cacbon tác dụng với H2
C + 2H2 ![small small xrightarrow[]{500^{0}C, Ni}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1548835405m6o1ukodwf.gif) CH4
CH4
b) Cacbon tác dụng với kim loại → muối cacbua:
4Al + 3C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) Al4C3
Al4C3
III. Ứng dụng của Cacbon – C
– Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.
– Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
– Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
– Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ.
– Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.
IV.Bài tập Cacbon – C
Bài 4 trang 70 SGK Hóa 11: Lập phương trình hóa học của các phản ứng sau đây:
a) H2SO4 đặc + C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) SO2 + CO2 + ?
SO2 + CO2 + ?
b) HNO3 đặc + C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) NO2 + CO2 + ?
NO2 + CO2 + ?
C) CaO + C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) CaC2 + CO
CaC2 + CO
d) SiO2 + C ![small xrightarrow[]{t^{0}}](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/giflatexsmallspacexrightarrowt_1548835395.gif) Si + CO
Si + CO
* Lời giải Bài 4 trang 70 SGK Hóa 11:
– Các phương trình phản ứng (cân bằng PTPƯ bằng PP thăng bằng electron):
a) 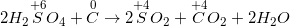
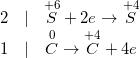
b) ![small small 4Hoverset{+5}{N}O_{3}+overset{0}{C}xrightarrow[]{t^{0}} 2overset{+4}{N}O_{2}+overset{+4}{C}O_{2}+2H_{2}O](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1548836977xvkcta1n3o.gif)
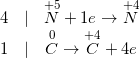
c) ![small small CaO+3overset{0}{C}xrightarrow[]{t^{0}} Caoverset{-1}{C}_{2}+overset{+2}{C}O](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/15488369804tsbr2hgjf.gif)
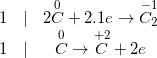
d) ![small small overset{+4}{Si}O_{2}+2overset{0}{C}xrightarrow[]{t^{0}} overset{0}{Si}+2overset{+2}{C}O](https://mamnonanhduongvt.edu.vn/wp-content/uploads/2022/08/1548836983uoyozczhia.gif)
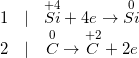
Bài 5 trang 70 SGK Hóa 11: Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
* Lời giải bài 5 trang 70 SGK Hóa 11:
+ quy đổi: 1,06 m3 = 1,06.1000 (lít) = 1060 (lít); 0,6 (kg) = 600 (g)
– Theo bài ra ta có: nCO2 = (1,06.1000)/22,4 = 47,32 (mol).
– Phương trình hoá học của phản ứng:
C + O2 → CO2
– Theo PTPƯ: nC = nCO2 = 47,32 (mol) ⇒ mC = 47,32.12 = 567,84 (g).
– Vậy % khối lượng của C là:
%mC = 567,84/600 = 94,64%
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hoá học của cacbon và bài tập ở trên hữu ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục