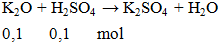Dưới đây Trường mầm non ánh dương cung cấp tài liệu về H2SO4 + K2O → H2O + K2SO4 | Cân Bằng Phương Trình Hóa Học H2SO4 | axit sulfuric | lỏng + K2O | kali oxit | lỏng = H2O | nước | lỏng + K2SO4 | Kali sunfat | lỏng, Điều kiện
Phương Trình Hoá Học Lớp 9 Phương Trình Hoá Học Lớp 11 Phản ứng trao đổi
This post: H2SO4 + K2O → H2O + K2SO4 | Cân Bằng Phương Trình Hóa Học
Cách viết phương trình đã cân bằng
| H2SO4 | + | K2O | → | H2O | + | K2SO4 |
| axit sulfuric | kali oxit | nước | Kali sunfat | |||
| Sulfuric acid; | Potassium oxide | Potassium sulfate | ||||
| (lỏng) | (lỏng) | (lỏng) | (lỏng) | |||
| (không màu) | (không màu) | (không màu) | (không màu) | |||
| Axit | Muối | |||||
| 98 | 94 | 18 | 174 |
Phương trình phản ứng: H2SO4 + K2O → H2O + K2SO4
H2SO4 + K2O → H2O + K2SO4 là Phản ứng trao đổi, H2SO4 (axit sulfuric) phản ứng với K2O (kali oxit) để tạo ra H2O (nước), K2SO4 (Kali sunfat) dười điều kiện phản ứng là Không có
- Điều kiện phản ứng để H2SO4 (axit sulfuric) tác dụng K2O (kali oxit) là gì ?
Không có
- Làm cách nào để H2SO4 (axit sulfuric) tác dụng K2O (kali oxit)?
Chúng mình không thông tin về làm thế nào để H2SO4 (axit sulfuric) phản ứng với K2O (kali oxit) và tạo ra chất H2O (nước) phản ứng với K2SO4 (Kali sunfat).
Nếu đang làm bài tập các bạn có thể viết đơn giản là H2SO4 (axit sulfuric) tác dụng K2O (kali oxit) và tạo ra chất H2O (nước), K2SO4 (Kali sunfat)
- Hiện tượng nhận biết nếu phản ứng xảy ra H2SO4 + K2O → H2O + K2SO4 là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), K2SO4 (Kali sunfat) (trạng thái: lỏng) (màu sắc: không màu), được sinh ra
Hoặc bạn phải quan sát chất tham gia H2SO4 (axit sulfuric) (trạng thái: lỏng) (màu sắc: không màu), K2O (kali oxit) (trạng thái: lỏng) (màu sắc: không màu), biến mất.
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng H2SO4 + K2O → H2O + K2SO4
Phản ứng giữa oxit bazo và axit tạo thành muối và nước
Ứng dụng thực tế H2SO4 + K2O → H2O + K2SO4
- Phương Trình Điều Chế Từ H2SO4 Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ H2SO4 (axit sulfuric) ra H2O (nước)
- Phương Trình Điều Chế Từ H2SO4 Ra K2SO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ H2SO4 (axit sulfuric) ra K2SO4 (Kali sunfat)
- Phương Trình Điều Chế Từ K2O Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ K2O (kali oxit) ra H2O (nước)
- Phương Trình Điều Chế Từ K2O Ra K2SO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ K2O (kali oxit) ra K2SO4 (Kali sunfat)
Câu hỏi trắc nghiệm và bài tập liên quan H2SO4 + K2O → H2O + K2SO4
Ví dụ 1:
Cho m gam K2O phản ứng vừa đủ với 100ml dung dịch H2SO4 1M. Giá trị của m là
A. 9,4. B. 4,7. C. 4,9. D. 7,4.
Hướng dẫn giải
m = 0.1.94 = 9,4 gam.
Đáp án A.
Ví dụ 2:
Chất nào sau đây không tác dụng với H2SO4?
A. KOH. B. K2O. C. K. D. K2SO4.
Hướng dẫn giải
K2SO4 không tác dụng với H2SO4.
Đáp án D.
Ví dụ 3:
Cho 4,7 gam K2O tác dụng với một lượng vừa đủ dung dịch H2SO4, thu được dung dịch X. Khối lượng chất tan có trong dung dịch X là
B. 7,7 gam. B. 8.7 gam. C. 9,7 gam. D. 10.7 gam.
Hướng dẫn giải
m = 0.05. 174 = 8,7 gam.
Đáp án B.
Mời các bạn tham khảo một số tài liệu quan
→ Tham khảo: Ứng dụng thực tế phương trình C2H4 + H2O → C2H5OH
………………………
Mầm Non Ánh Dương đã gửi tới bạn phương trình hóa học H2SO4 + K2O → H2O + K2SO4, khi cho dung dịch H2SO4 (axit sulfuric) phản ứng với K2O (kali oxit) để tạo ra H2O (nước), K2SO4 (Kali sunfat). Hy vọng với tài liệu này sẽ cung cấp các thông tin cần thiết cho các bạn.
Ngoài ra, Mầm Non Ánh Dương đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook: Tài liệu học tập lớp 11. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.
Chúc các bạn học tập tốt.
Source: Mamnonanhduongvt.edu.vn
Category: Phương Trình Hoá Học Lớp 9