Fe + CuSO4 = Cu + FeSO4 | Cân Bằng Phương Trình Hóa Học
Fe | sắt | rắn + CuSO4 | Đồng(II) sunfat | dd = Cu | đồng | rắn + FeSO4 | Sắt(II) sunfat | dd, Điều kiện
Mục Lục
-
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình Fe + CuSO4 → Cu + FeSO4
- Điều kiện phản ứng để Fe (sắt) tác dụng CuSO4 (Đồng(II) sunfat) là gì ?
- Làm cách nào để Fe (sắt) tác dụng CuSO4 (Đồng(II) sunfat)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Fe + CuSO4 → Cu + FeSO4 là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Fe + CuSO4 → Cu + FeSO4 ?
- Giải thích chi tiết về các phân loại của phương trình Fe + CuSO4 → Cu + FeSO4
- Phản ứng oxi-hoá khử là gì ?
- Phản ứng thế là gì ?
- Chuỗi phương trình hóa học có sử dụng Fe + CuSO4 → Cu + FeSO4
Cách viết phương trình đã cân bằng
 |
 |
 |
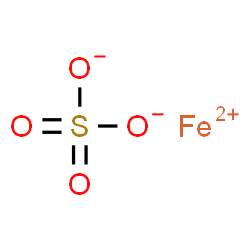 |
|||
| Fe | + | CuSO4 | → | Cu | + | FeSO4 |
| sắt | Đồng(II) sunfat | đồng | Sắt(II) sunfat | |||
| Iron | Copper(II) sulfate | Copper | Iron (II) sulfate | |||
| (rắn) | (dd) | (rắn) | (dd) | |||
| (trắng xám) | (xanh lam) | (đỏ) | (lục nhạt) | |||
| Muối | Muối | |||||
| 56 | 160 | 64 | 152 |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
This post: Fe + CuSO4 → Cu + FeSO4
☟☟☟
Thông tin chi tiết về phương trình Fe + CuSO4 → Cu + FeSO4
Fe + CuSO4 → Cu + FeSO4 là Phản ứng oxi-hoá khửPhản ứng thế, Fe (sắt) phản ứng với CuSO4 (Đồng(II) sunfat) để tạo ra Cu (đồng), FeSO4 (Sắt(II) sunfat) dười điều kiện phản ứng là Không có
Điều kiện phản ứng để Fe (sắt) tác dụng CuSO4 (Đồng(II) sunfat) là gì ?
Không có
Làm cách nào để Fe (sắt) tác dụng CuSO4 (Đồng(II) sunfat)?
Cho đinh sắt vào dung dịch CuSO4
Nếu đang làm bài tập các bạn có thể viết đơn giản là Fe (sắt) tác dụng CuSO4 (Đồng(II) sunfat) và tạo ra chất Cu (đồng), FeSO4 (Sắt(II) sunfat)
Hiện tượng nhận biết nếu phản ứng xảy ra Fe + CuSO4 → Cu + FeSO4 là gì ?
Chất rắn màu trắng xám Sắt (Fe) bị 1 lớp đỏ đồng Cu phủ lên bề mặt.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Fe + CuSO4 → Cu + FeSO4
Kết luận sắt hoạt động hoá học manh hơn đồng
Phương Trình Điều Chế Từ Fe Ra Cu
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe (sắt) ra Cu (đồng)
Xem tất cả phương trình điều chế từ Fe (sắt) ra Cu (đồng)
Phương Trình Điều Chế Từ Fe Ra FeSO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe (sắt) ra FeSO4 (Sắt(II) sunfat)
Xem tất cả phương trình điều chế từ Fe (sắt) ra FeSO4 (Sắt(II) sunfat)
Phương Trình Điều Chế Từ CuSO4 Ra Cu
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ CuSO4 (Đồng(II) sunfat) ra Cu (đồng)
Xem tất cả phương trình điều chế từ CuSO4 (Đồng(II) sunfat) ra Cu (đồng)
Phương Trình Điều Chế Từ CuSO4 Ra FeSO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ CuSO4 (Đồng(II) sunfat) ra FeSO4 (Sắt(II) sunfat)
Xem tất cả phương trình điều chế từ CuSO4 (Đồng(II) sunfat) ra FeSO4 (Sắt(II) sunfat)
Giải thích chi tiết về các phân loại của phương trình Fe + CuSO4 → Cu + FeSO4
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Phản ứng thế là gì ?
Phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử hợp chất hữu cơ bị thay thê bởi một nguyên tử hoặc nhóm nguyên tử khác. Phản ứng thế cũng là một loại phương trình hoá học cực kỳ phổ biến trong chương trình trung học cơ sở và trung học phổ thông.
Xem tất cả phương trình Phản ứng thế
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Fe + CuSO4 → Cu + FeSO4
Click để xem tất cả câu hỏi có liên quan tới phương trình Fe + CuSO4 → Cu + FeSO4
Câu 1. Ứng dụng
Trong các hiện tượng thực hành dưới đây, hiện tượng nào miêu tả không chính xác.
A. Cho mẩu Na vào dung dịch đựng FeCl3 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ.
B. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa tan
C. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang màu đỏ.
D. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt CuSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
Câu B.
Câu 2. Điều chế
Phản ứng điều chế kim loại nào sau đây thuộc phản ứng thủy luyện?
A. CuO + CO → Cu + CO2
B. 2Al + 3CuO → Al2O3 + 3Cu
C. Fe + CuSO4 → Cu + FeSO4
D. CuSO4 + H2O → Cu + 0,5O2 + H2SO4
Câu C.
Câu 3. phương pháp loại tạp chất
Dung dịch FeSO4 bị lẫn CuSO4. Phương pháp đơn giản để loại tạp chất là :
A. Cho một lá nhôm vào dung dịch
B. Cho lá sắt vào dung dịch
C. Cho lá đồng vào dung dịch
D. Cho dung dịch NH3 cho đến dư vào dung dịch, lọc lấy kết tủa Fe(OH)2 rồi hoà tan vào dung dịch H2SO4 loãng.
Câu B.
Câu 4. Sắt
Nhúng thanh Fe nặng m gam vào 300 ml dung dịch CuSO4 1M, sau một thời gian, thu được dung dịch X có chứa CuSO4 0,5M, đồng thời khối lượng thanh Fe tăng 4% so với khối lượng ban đầu. Giả sử thể tích dung dịch không thay đổi và lượng Cu sinh ra bám hoàn toàn vào thanh sắt. Giá trị m là.
A. 24 gam.
B. 30 gam.
C. 32 gam.
D. 48 gam.
Câu B.
Câu 5. Bài toán khối lượng
Cho m gam bột Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và 9,2 gam chất rắn Y. Giá trị của m là
A. 5,6.
B. 8,4.
C. 11,2.
D. 2,8.
Câu B.
Source: Mamnonanhduongvt.edu.vn
Category: Phương Trình Hoá Học Lớp 10