Cách tính hoá trị của 1 nguyên tố trong hợp chất hóa học là một dạng toán đơn giản để các em lớp 8 hiểu về sự kết hợp các nguyên tố trong hợp chất.
Trong bài viết này chúng ta cùng tìm hiểu cách tính hoá trị của 1 nguyên tố trong hợp chất hoá học một cách chi tiết và dễ hiểu để các em chuẩn bị tốt kiến thức nền tảng cho các bài học tiếp theo.
This post: Cách tính hoá trị của nguyên tố trong hợp chất và bài tập áp dụng – Hoá lớp 8
I. Hoá trị của một nguyên tố
– Quy ước: Hidro (H) có hoá trị I và Oxi (O) có hoá trị II
– Từ cách xác định hoá trị của 1 nguyên tố có thể xác định hoá trị của nhóm nguyên tử, ví dụ H2SO4 thì (SO4) có hoá trị II, H2O (có thể viết là HOH) thì nhóm (OH) có hoá trị I.
Ví dụ: HCl (axit clohiđric) thì Clo có hoá trị I ; NH3 (Amoniac) thì Nitơ có hoá trị III.
⇒ Hoá trị của một nguyên tố: Là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác
– Chú ý: Kết quả tính hoá trị ghi số La Mã

II. Cách tính Hoá trị của một nguyên tố hay của một hợp chất
– Cho công thức hoá học của hợp chất 2 nguyên tố bất kỳ: 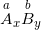
– Công thức tính hoá trị: 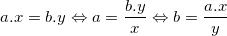
– Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
⇒ Cách tính hoá trị của nguyên tố A: 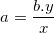
⇒ Cách tính hoá trị của nguyên tố B: 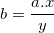
Ví dụ: Tính hoá trị của Fe trong hợp chất FeCl3 biết clo hoá trị I, của CO2 biết oxi hoá trị II, Tính hóa trị của Fe trong FeSO4 biết SO4 có hoá trị II, Fe2(CO3)3 biết CO3 có hoá trị II.
Hướng dẫn:
– Gọi a là hoá trị của Fe trong hợp chất FeCl3 ta có: 1.a = 3.I ⇒ a = III (hoặc có ngay: 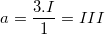 ) (vậy Fe có hoá trị III)
) (vậy Fe có hoá trị III)
– Gọi a là hoá trị của C trong hợp chất CO2 ta có: 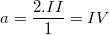 (vậy C có hoá trị IV)
(vậy C có hoá trị IV)
– Gọi a là hoá trị của Fe trong hợp chất FeSO4 ta có: 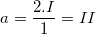 (vậy Fe có hoá trị II)
(vậy Fe có hoá trị II)
– Gọi a là hoá trị của Fe trong hợp chất Fe2(CO3)3 ta có: 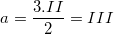 (vậy Fe có hoá trị III)
(vậy Fe có hoá trị III)
* Nhận xét: Từ trên ta thấy trong mỗi hợp chất Fe có hoá trị II, hoặc III nên gọi sắt là nguyên tố đa hoá trị (có từ 2 hoá trị khác nhau trở lên).
III. Bài tập về cách tính hoá trị 1 nguyên tố trong hợp chất.
Bài tập 1: Tính hoá trị các nguyên tốt sau
1) Na2O 2) P2O5 3) SO2 4) Al2O3
5) SO3 6) Cu2O 7) N2O5 8) Fe2O3
9) H2S 10) SiO2 11) PH3 12) FeO
Bài tập 2: Tính hoá trị các nguyên tố sau biết Oxi có hoá trị II
1) CaO 2) CuO 3) Cr2O3 4) MnO2
5) NO2 6) PbO2 7) MgO 8) NO 9) ZnO
10) PbO 11) BaO 12) N2O 13) CO 14) K2O
Đáp án bài 1:
1) Na (I) 2) P (V) 3) S (IV) 4) AL (III)
5) S (VI) 6) Cu (I) 7) N (V) 8) Fe (III)
9) S (II) 10) Si (IV) 11) P (III) 12) Fe (II)
Đáp án bài 2:
1) Ca (II) 2) Cu (II) 3) Cr (III) 4) Mn (IV)
5) N (IV) 6) Pb (IV) 7) Mg (II) 8) N (II)
9) Zn (II) 10) Pb (II) 11) Ba (II) 12) N (I)
13) C (II) 14) K (I)
Bài 1 trang 41 sgk hóa 8: Tính hóa trị của đồng Cu, phốt pho P, Silic Si và sắt Fe trong các công thức hóa học sau: Cu(OH)2, PCl5, SiO2, Fe(NO3)3
* Lời giải bài 1 trang 41 sgk hóa 8:
– Nhóm OH hóa trị I nên ⇒ Cu có hóa trị là II
– Cl có hóa trị là I nên ⇒ P có hóa trị là V
– O có hóa trị là II nên ⇒ Si có hóa trị là IV
– Nhóm NO3 có hóa trị I nên ⇒ Fe có hóa trị là III
Bài 2 trang 41 sgk hóa 8: Cho công thức hóa học của hợp chất X với oxi là XO, hợp chất Y với H là YH3 (X, Y là nguyên tố hóa học nào đó). Hãy chọn công thức hóa học đúng giữa X và Y trong các công thức sau: a) XY3 b) X3Y c) X2Y3 d) X3Y2
* Lời giải bài 2 trang 41 sgk hóa 8:
- Đáp án: d) X3Y2
– HD: hợp chất XO ⇒ X (II); hợp chất YH3 ⇒ Y (III)
Trên đây là cách tính hoá trị của một nguyên tố trong hợp chất hoá học, hy vọng bài viết hữu ích cho các em và chúc các em học tốt, mọi thắc mắc các em hãy để lại bình luận dưới bài viết để thầy cô trường THPT Sóc Trăng chia sẻ nhé.
Xem thêm Cách tính hoá trị của 1 nguyên tố trong hợp chất hóa học
Cách tính hoá trị của 1 nguyên tố trong hợp chất hóa học là một dạng toán đơn giản để các em lớp 8 hiểu về sự kết hợp các nguyên tố trong hợp chất. Trong bài viết này chúng ta cùng tìm hiểu cách tính hoá trị của 1 nguyên tố trong hợp chất hoá học một cách chi tiết và dễ hiểu để các em chuẩn bị tốt kiến thức nền tảng cho các bài học tiếp theo. I. Hoá trị của một nguyên tố – Quy ước: Hidro (H) có hoá trị I và Oxi (O) có hoá trị II – Từ cách xác định hoá trị của 1 nguyên tố có thể xác định hoá trị của nhóm nguyên tử, ví dụ H2SO4 thì (SO4) có hoá trị II, H2O (có thể viết là HOH) thì nhóm (OH) có hoá trị I. Ví dụ: HCl (axit clohiđric) thì Clo có hoá trị I ; NH3 (Amoniac) thì Nitơ có hoá trị III. ⇒ Hoá trị của một nguyên tố: Là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác – Chú ý: Kết quả tính hoá trị ghi số La Mã II. Cách tính Hoá trị của một nguyên tố hay của một hợp chất – Cho công thức hoá học của hợp chất 2 nguyên tố bất kỳ: – Công thức tính hoá trị: – Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia. ⇒ Cách tính hoá trị của nguyên tố A: ⇒ Cách tính hoá trị của nguyên tố B: Ví dụ: Tính hoá trị của Fe trong hợp chất FeCl3 biết clo hoá trị I, của CO2 biết oxi hoá trị II, Tính hóa trị của Fe trong FeSO4 biết SO4 có hoá trị II, Fe2(CO3)3 biết CO3 có hoá trị II. Hướng dẫn: – Gọi a là hoá trị của Fe trong hợp chất FeCl3 ta có: 1.a = 3.I ⇒ a = III (hoặc có ngay: ) (vậy Fe có hoá trị III) – Gọi a là hoá trị của C trong hợp chất CO2 ta có: (vậy C có hoá trị IV) – Gọi a là hoá trị của Fe trong hợp chất FeSO4 ta có: (vậy Fe có hoá trị II) – Gọi a là hoá trị của Fe trong hợp chất Fe2(CO3)3 ta có: (vậy Fe có hoá trị III) * Nhận xét: Từ trên ta thấy trong mỗi hợp chất Fe có hoá trị II, hoặc III nên gọi sắt là nguyên tố đa hoá trị (có từ 2 hoá trị khác nhau trở lên). III. Bài tập về cách tính hoá trị 1 nguyên tố trong hợp chất. Bài tập 1: Tính hoá trị các nguyên tốt sau 1) Na2O 2) P2O5 3) SO2 4) Al2O3 5) SO3 6) Cu2O 7) N2O5 8) Fe2O3 9) H2S 10) SiO2 11) PH3 12) FeO Bài tập 2: Tính hoá trị các nguyên tố sau biết Oxi có hoá trị II 1) CaO 2) CuO 3) Cr2O3 4) MnO2 5) NO2 6) PbO2 7) MgO 8) NO 9) ZnO 10) PbO 11) BaO 12) N2O 13) CO 14) K2O Đáp án bài 1: 1) Na (I) 2) P (V) 3) S (IV) 4) AL (III) 5) S (VI) 6) Cu (I) 7) N (V) 8) Fe (III) 9) S (II) 10) Si (IV) 11) P (III) 12) Fe (II) Đáp án bài 2: 1) Ca (II) 2) Cu (II) 3) Cr (III) 4) Mn (IV) 5) N (IV) 6) Pb (IV) 7) Mg (II) 8) N (II) 9) Zn (II) 10) Pb (II) 11) Ba (II) 12) N (I) 13) C (II) 14) K (I) Bài 1 trang 41 sgk hóa 8: Tính hóa trị của đồng Cu, phốt pho P, Silic Si và sắt Fe trong các công thức hóa học sau: Cu(OH)2, PCl5, SiO2, Fe(NO3)3 * Lời giải bài 1 trang 41 sgk hóa 8: – Nhóm OH hóa trị I nên ⇒ Cu có hóa trị là II – Cl có hóa trị là I nên ⇒ P có hóa trị là V – O có hóa trị là II nên ⇒ Si có hóa trị là IV – Nhóm NO3 có hóa trị I nên ⇒ Fe có hóa trị là III Bài 2 trang 41 sgk hóa 8: Cho công thức hóa học của hợp chất X với oxi là XO, hợp chất Y với H là YH3 (X, Y là nguyên tố hóa học nào đó). Hãy chọn công thức hóa học đúng giữa X và Y trong các công thức sau: a) XY3 b) X3Y c) X2Y3 d) X3Y2 * Lời giải bài 2 trang 41 sgk hóa 8: Đáp án: d) X3Y2 – HD: hợp chất XO ⇒ X (II); hợp chất YH3 ⇒ Y (III) Trên đây là cách tính hoá trị của một nguyên tố trong hợp chất hoá học, hy vọng bài viết hữu ích cho các em và chúc các em học tốt, mọi thắc mắc các em hãy để lại bình luận dưới bài viết để thầy cô trường THPT Sóc Trăng chia sẻ nhé. Đăng bởi: Mầm Non Ánh Dương Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục