Bộ đề thi học kì 2 môn Hóa học lớp 9 năm 2020 – 2021 gồm 5 đề kiểm tra cuối học kì 2 lớp 9 có đáp án chi tiết kèm theo bảng ma trận đề thi. Qua đó giúp các em học sinh lớp 9 ôn tập và củng cố kiến thức chuẩn bị cho bài thi học kì 2 sắp tới được tốt hơn.
Đồng thời, cũng giúp thầy cô giáo tham khảo để ra đề thi học kỳ 2 cho học sinh của mình. Ngoài ra, thầy cô và các em còn có thể tham khảo thêm bộ đề thi môn Ngữ văn, Toán, Lịch sử, Sinh học. Chúc các bạn học tốt.
This post: Bộ đề thi học kì 2 môn Hóa học lớp 9 năm 2020 – 2021
Đề thi học kì 2 môn Hóa học lớp 9 năm 2020 – 2021 – Đề 1
Ma trận đề thi học kì 2 môn Hóa học lớp 9
| Nội dung | Mức độ nhận thức | Tổng | ||||||||
| Nhận biết | Thông hiểu | Vận dụng | Vận dụng ở mức cao hơn | |||||||
| TN | TL | TN | TL | TN | TL | TN | TL | |||
|
CHƯƠNG 3: Phi kim – Sơ lược về bảng tuần hoàn các NTHH. |
– Số thứ tự của chu kì. – Sự biến đổi tính kim loại, phi kim trong một nhóm. |
2(1) 10% |
||||||||
|
Số câu |
2 câu |
|||||||||
|
Số điểm Tỉ lệ |
1 10 % |
|||||||||
|
CHƯƠNG 4 : Hiđrocacbon – Nhiên liệu. |
– Chỉ ra các hợp chất hữu cơ. |
– Tính theo PTHH. – Tính chất của các Hirocacbon. – Viết PTHH thực hiện dãy chuyển hóa. |
4(3,5) 35 % |
|||||||
|
Số câu |
1 câu |
2 câu |
1 câu |
|||||||
|
Số điểm Tỉ lệ |
0,5 5% |
1 10% |
2 20% |
|||||||
|
CHƯƠNG : Dẫn xuất của Hidrocacbon – Polime. |
– Nhận biết các dẫn xuất của Hidrocacbon. |
– Tính toán theo PTHH. . |
– Xác đinh công thức phân tử hợp chất hữu cơ. |
4(5,5 ) 55% |
||||||
|
Số câu |
1 câu |
1 câu |
1 câu |
1 Câu |
||||||
|
Số điểm Tỉ lệ |
0,5 5% |
1,5 15% |
2,5 25% |
1 10% |
||||||
|
Tổng |
3(1,5 ) |
3(1,5) |
2(3,5) |
1(2,5) |
1(1) |
|||||
|
2(1,5) 15% |
5(5) 50% |
1(2,5) 25% |
1(1) 10% |
10(10) 100% |
||||||
Đề kiểm tra học kì 2 lớp 9 môn Hóa học
Phần I: Trắc nghiệm (3 điểm) Chọn một trong các chữ cái A, B, C, D trước câu trả lời đúng:( Mỗi câu trả lời đúng được 0,5 điểm)
Câu 1: Số thứ tự của nhóm cho biết:
A. Số electron lớp ngoài cùng
B. Số lớp electron
C. Kí hiệu hóa học và tên nguyên tố
D. nguyên tử khối của nguyên tố
Câu 2: Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân nguyên tử thì:
A. Tính kim loại và tính phi kim đều giảm.
B. Tính kim loại giảm dần, tính phi kim tăng dần.
C. Tính kim loại và phi kim đều tăng.
D. Tính kim loại tăng dần, tính phi kim giảm dần.
Câu 3: Dãy đều gồm các hợp chất hữu cơ là:
A. CH4, C2H6O, CaO
B. CH3COOH, HCl, CH3OH
C. CH3COONa, CaCl2, C2H5Cl
D. C2H6O, C6H12O6, C12H22O11
Câu 4: Hòa tan hoàn toàn 32,5 gam Zn trong 200 g dung dịch CH3COOH a%, vừa đủ. Giá trị của a là
A. 15 %
B. 30 %
C. 45 %
D. 60%
Câu 5: Dẫn từ từ 4,48 lít ( ở điều kiện tiêu chuẩn) hỗn hợp X gồm CH4, C2H4 qua dung dịch Brom dư, thấy khối lượng Brom phản ứng là 16 gam. Thành phần phần trăm về thể tích của CH4, C2H4 trong hỗn hợp X là: :
A. 25% và 75%
B. 75% và 25%
C. 50 % và 50%
D. 40 % và 60%
Câu 6: Có ba dung dịch : rượu etylic, axit axetic, glucozơ. Để phân biệt ba dung dịch trên cần dùng :
A. Quỳ tím, Ag2O trong dung dịch Amonniac
B. NaOH, Ag2O trong dung dịch Amoniac
C. Zn, NaOH
D. NaOH, quỳ tím.
Phần II : Tự Luận ( 7 điểm)
Câu 1: (2 điểm) Viết các phương trình hóa học thực hiện dãy chuyển hóa sau:
CH4 → C2H2 → C2H4 → CH3–CH2–OH → CH3–COOH→ CH3–COOC2H5
Câu 2: (1,5 điểm)
Có 3 lọ không nhãn đựng 3 dung dịch không màu: hồ tinh bột, glucozơ, saccarozo.
Hãy nêu cách nhận biết các chất trên bằng phương pháp hóa học.
Câu 3: (2,5 điểm) Hòa tan hoàn toàn 11,3 g hốn hợp A gồm Mg, Zn trong 200 g dung dịch CH3-COOH nồng độ a % ,vừa đủ tạo thành dung dịch A; 6,72 lít khí Hidro ở điều kiện tiêu chuẩn. Hãy:
a, Viết phương trình hóa học của phản ứng trên ?
b, Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp A ban đầu?
c, Tính nồng độ phần trăm của dung dịch CH3-COOH đã dùng và dung dịch muối thu được sau phản ứng?
Câu 4 (1,0 điểm) Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ A thu được 17,6 g khí CO2 và 9 g H2O. Biết phân tử chất A chỉ chứa một nguyên tử oxi trong phân tử và tác dụng được với Natri giải phóng H2. Hãy xác định công thức phân tử và công thức cấu tạo có thể có của A.
(Biết H=1;C=12;O=16;S=32, Cl =35,5; Mg = 24; Fe = 56, Zn=65)
Đáp án đề thi học kì 2 môn Hóa học lớp 9
Phần I: Trắc nghiệm (3 điểm)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | A | B | D | B | C | A |
Phần II: Tự luận (7 điểm)
Câu 1: (2 điểm) :
– Hoàn thành mỗi PTHH 0,4 điểm
Câu 2: (1,5 điểm)
– Trích mẫu thử và đánh số thứ tự (0,25 điểm)
– Dùng dung dịch Iot để nhận ra hồ tinh bột ( 0,5 điểm)
– Dùng Ag2O trong dung dịch Amoniac nhận ra Glucozơ (0,5 điêm)
– Chất còn lại là Saccarozo. (0,25 điểm)
Câu 3: (2,5 điểm)
PTHH: Zn + 2CH3-COOH → (CH3-COO)2Zn + H2(0,25 điểm)
Mg + 2CH3-COOH → (CH3-COO)2Mg + H2 (0,25 điểm)
%mMg=42,5%; %mzn = 57,5% (1 điểm)
18 % ; 13,5 %; 8,7% (1 điểm)
Câu 4: (1 điểm)
CTPT : C4H10O
Đề thi học kì 2 môn Hóa học lớp 9 năm 2020 – 2021 – Đề 2
Ma trận đề thi học kì 2 môn Hóa học lớp 9
| Nội dung kiến thức | Mức độ nhận thức | Cộng | |||
| Nhận biết | Thông hiểu | Vận dụng | Vận dụng ở mức cao hơn | ||
|
Sơ lược bảng tuần hoàn các nguyên tố hóa học (2 tiết) |
– Nêu được ý nghĩa của bảng tuần hoàn các nguyên tố hóa học. – Nêu được nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. |
||||
|
Số câu Số điểm Tỉ lệ:% |
Câu 1a 1 điểm (10 %) |
0,5 câu 1 điểm (10%) |
|||
|
Hidrocacbon – nhiên liệu (10 tiết) |
Biết được cấu tạo phân tử và ứng dụng của benzen |
Giải được bài tập tìm công thức phân tử của hợp chất hữu cơ – hidrocacbon đơn giản |
|||
|
Số câu Số điểm Tỉ lệ:% |
Câu 1b 2 điểm (20 %) |
Câu 3 2,5 điểm (25%) |
1,5 câu 4,5 điểm (45%) |
||
|
Dẫn xuất của hidrocacbon (11 tiết) |
– Hiểu được mối liên hệ của các chất: rượu etylic, saccarozơ, glucozơ, axit axetic. Viết PTHH minh họa. – Dựa vào tính chất hóa học khác nhau của saccarozo và glucozo và axit axetic để làm bài tập nhận biết. |
– Thấy được tác hại của rượu đến sức khỏe. |
|||
|
Số câu Số điểm Tỉ lệ:% |
Câu 2, 4a 3,5 điểm (35%) |
Câu 4b 0,5 điểm (10%) |
2 câu 4 điểm (45%) |
||
|
Tổng số câu Tổng số điểm Tổng (%) |
1 câu 3,0 điểm (30%) |
1,5 câu 3,5 điểm (35%) |
1 câu 2,5 điểm (25%) |
0,5 câu 1,0 điểm (10%) |
4 câu 10 điểm 100% |
Đề kiểm tra học kì 2 lớp 9 môn Hóa học
Câu 1: (3 điểm)
Em hãy cho biết:
a. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn và ý nghĩa của bảng tuần hoàn.
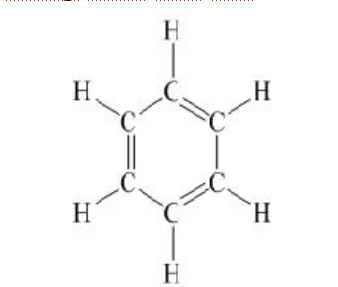
b. Cấu tạo phân tử và ứng dụng của benzen.
Câu 2: (2,0 điểm)
Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện phản ứng) :
C12H22O11 → C6H12O6 → C2H5OH →CH3COOH →CH3COOC2H5
Câu 3: (2,5 điểm)
Đốt cháy hoàn toàn 16,8 gam hợp chất hữu cơ A thu được 52,8 gam khí CO2 và 21,6 gam H2O. Biết khối lượng mol của A là 56 g/mol.
a. Trong hợp chất hữu cơ A có những nguyên tố nào?
b. Tìm công thức phân tử của A.
Câu 4: (2,5 điểm)
a, Có ba lọ không nhãn đựng ba chất lỏng là: saccarozơ, axit axetic và glucozơ. Bằng phương pháp hóa học hãy nhận biết các chất lỏng trên.
b. Nêu 4 tác hại của rượu ảnh hưởng đến sức khỏe con người.
(Cho: C = 12, H =1, O = 16)
Đáp án đề thi học kì 2 môn Hóa học lớp 9
|
Câu |
Đáp án |
Biểu điểm |
|
1 |
a. – Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. – Ý nghĩa của bảng tuần hoàn: + Biết vị trí của nguyên tố suy ra cấu tạo nguyên tử và tính chất của nguyên tố. + Biết cấu tạo nguyên tử suy ra vị trí và tính chất của nguyên tố. b. – Công thức cấu tạo:
– Đặc điểm cấu tạo: + Phân tử benzen có sáu nguyên tử C liên kết với nhau tạo thành vòng sáu cạnh đều. + Có 3 liên kết đơn xen kẽ với 3 liên kết đôi. – Ứng dụng của benzen: + Là nguyên liệu quan trọng trong công nghiệp để sản xuất chất dẻo, phẩm nhuộm, thuốc trừ sâu, dược phẩm… + Làm dung môi trong công nghiệp và trong phòng thí nghiệm. |
0,5 điểm 0,25 điểm 0,25 điểm 0,5 điểm 0,25 điểm 0,25 điểm 0,5 điểm 0,5 điểm |
………………
Mời các bạn tải file tài liệu để xem thêm nội dung chi tiết
Bản quyền bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục