Bộ đề thi giữa học kì 2 môn Hóa học lớp 9 năm 2021 – 2022 gồm 5 đề kiểm tra giữa kì 2, giúp các bạn ôn tập lại các kiến thức đã học, đánh giá năng lực làm bài của mình và chuẩn bị cho bài kiểm tra giữa học kì được tốt hơn.
Toàn bộ 5 đề kiểm tra giữa kì 2 lớp 9 môn Hóa học được chọn lọc kỹ càng từ các trường THCS trên cả nước, giúp các bạn học sinh làm quen với các dạng đề, cấu trúc, và biết được khả năng của mình khi giải đề, từ đó giúp các bạn tự tin hơn trong kỳ thi giữa học kì 2 lớp 9 sắp tới.
This post: Bộ đề thi giữa học kì 2 môn Hóa học lớp 9 năm 2021 – 2022
Đề thi giữa học kì 2 môn Hóa học lớp 9 – Đề 1
Ma trận đề thi giữa kì 2 lớp 9 môn Hóa học
| NỘI DUNG CHÍNH | NHẬN BIẾT | THÔNG HIỂU | VẬN DỤNG | TỔNG | |||
| TN | TL | TN | TL | TN | TL | ||
| Chương 3:
Phi kim và sơ lược về………. |
Câu 1
2đ |
Câu 1
2đ |
3,75 đ | ||||
| Chương 4: hiđrocacbon. | Câu 2 ý 3,4 ,8(0,75 đ) | 0,75 đ | |||||
| TỔNG | 3 đ | 5 đ | 2 đ | 10 điểm | |||
Đề thi giữa học kì 2 môn Hóa học lớp 9
Phần trắc nghiệm ( 4 điểm):
Câu 1: (1,5 điểm):Cho các cụm từ sau: electron , lớp electron, kim loại, phi kim, hai, tan, tăng dần, giảm dần, tan nhiều điền vào dấu ……trong các câu sau:
– Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số (1)………………… và được xếp theo chiều điện tích hạt nhân tăng dần.
– Nhóm II gồm các nguyên tố (2)………………..Nguyên tử của chúng đều có (3)…………
electron lớp ngoài cùng. Tính kim loại của các nguyên tố (4)………………….
– Nhỏ vài giọt benzen vào ống nghiệm đựng nước, lắc nhẹ, benzen không (5)………………
trong nước nhưng (6)…………….. trong dầu ăn.
Câu 2: (2,5 điểm): Nối các ý ở cột A với các ý ở cột B để hoàn thành cột C trong bảng sau:
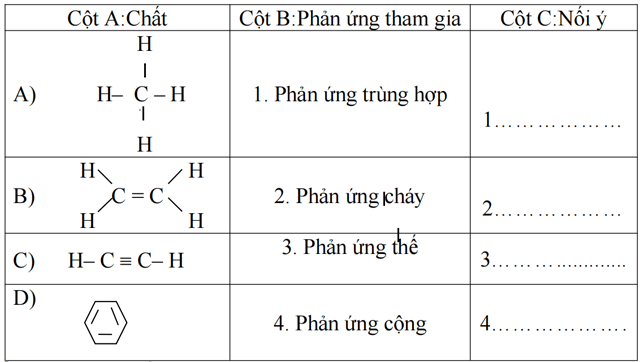
Phần tự luận:(6 điểm):
Câu 3: ( 2điểm): Viết công thức cấu tạo dạng mạch thẳng của các chất hữu cơ có công thức phân tử sau: C3H7Cl, C3H6, C3H4
Câu 4: (1điểm): Nêu phương pháp hóa học để phân biệt các khí CH4, C2H4, CO2 ?
Câu 5 🙁 3 điểm): Đốt cháy 14 ml hỗn hợp khí mêtan và axetilen cần phải dùng 33,6ml khí oxi.Tính phần trăm thể tích của mỗi khí trong hỗn hợp.( Các khí đo ở đktc)
————–Hết————–
Đáp án đề thi giữa kì 2 lớp 9 môn Hóa
Phần trắc nghiệm: (4 điểm)
Câu 1:(1,5 điểm): Điền đúng 1 ý được 0,25đ
1) lớp electron
2) kim loại
3) hai
4) tăng dần
5) tan
6) tan nhiều
Câu 2: (2,5 điểm): Điền đúng 1 phản ứng được 0,25 điểm
1-B
2- A, B, C, D
3- A, D
4- B,C, D
………………………………….
Đề thi giữa kì 2 lớp 9 môn Hóa học – Đề 2
Ma trận đề thi giữa kì 2 môn Hóa học lớp 9
| Cấp độNộidung | Nhận biết | Thông hiểu | Vận dụng | TổngĐiểm | |||||
| VD thấp | VD cao | ||||||||
| TN | TL | TN | TL | TN | TL | TN | TL | ||
| Muối cacbonat | C5 | C14 | |||||||
| Số điểm | 0,25đ | 2đ | 2,25đ | ||||||
| Silic. Công nghiệp silicat | C8 | ||||||||
| Số điểm | 0,25đ | 0,25đ | |||||||
| Bảng THHH | C11 | C1 | C9 | ||||||
| Số điểm | 0,25đ | 0,25đ | 0,25đ | 0,75đ | |||||
| Khái niệm hợp chất hữu cơ. | C2 | C10 | C3 | ||||||
| Số điểm | 0,25đ | 0,25đ | 0,25đ | 0,75đ | |||||
| Metan, Etilen, Axetilen | C6, C12 | C7 | C13.13,
14,15,16 |
C15c | |||||
| Số điểm | 0,5đ | 0,25đ | 1đ | 9C-1đ | 1,75đ
9C-2,75đ |
||||
| Bài tập tính toán | C4 | C15a,b | |||||||
| Số điểm | 0,25đ | 4đ
9C-3đ |
4,25đ
9C-3,25đ |
||||||
| T.câu
T. điểm |
5 câu
1,25đ |
3 câu
0,75đ |
8 câu
2đ |
2 câu
6đ 1,5 câu 9C-5đ |
0,5 câu
9C-1đ |
10đ | |||
Đề thi giữa học kì 2 môn Hóa học lớp 9
I. Trắc nghiệm khách quan: (4 điểm)(0,25 đ/câu) Chọn đáp án đúng nhất điền vào ô trống:
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 | Câu 11 | Câu 12 | Câu 13.13 | Câu 13.14 | Câu 13.15 | Câu 13.16 |
Câu 1: Khi nhiệt phân muối Cacbonat, khí sinh ra là:
A. SO3
B. CO2
C. O2
D. SO2
Câu 2: Chất không được đựng trong lọ thủy tinh là:
A. HCl
B. HNO3
C. H2SO4
D. HF
Câu 3: Phần trăm về khối lượng của Cacbon trong phân tử CH4 là:
A. 25%
B. 50%
C. 100%
D. 75%
Câu 4: Nhóm chất đều là dẫn xuất của hiđrocacbon là:
A. CH3NO2; CH3Br; C2H6O
B. NaC6H5; CH4O; HNO3; C6H6
C. CH4; C2H4; C2H2; C6H6
D. FeCl3; C2H6O;CH4;NaHCO3
Câu 5: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi
C. một liên kết ba.
D. hai liên kết đôi.
Câu 6: Hóa chất dùng để phân biết khí metan và khí etilen là
A,. dung dịch nước Brom
B. dung dịch Natrihidroxit
C. dung dịch phenolphtalein
D. dung dịch nước vôi trong.
Câu 7: Lượng Oxi cần dùng để đốt cháy 4,48 lít khí etilen là
A.4,48 lít
B. 8,96 lít
C. 13,44 lít
D. 6,72 lít
Câu 8: Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết:
A.Số thứ tự của nguyên tố
B. Số electron lớp ngoài cùng
C.Số hiệu nguyên tử
D. Số lớp electron.
Câu 9: Sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần:
A. Na, Mg, Al, K
B, Na, Mg, Al
C. Al, K, Na, Mg
D. Mg, K, Al, Na
Câu 10: Nguyên tố M có số hiệu nguyên tử là 13. M thuộc nhóm nào của bảng tuần hoàn?
A. IIA
B. IIB
C. IIIA
D. IB
Câu 11: Chất nào sau đây thuộc loại chất hữu cơ?
A. Al2C4
B. CH4
C. CO
D. Na2CO3
Câu 12: Tính chất vật lí của etilen là:
A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí.
D. Chất khí, không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí.
Câu 13: Kết luận đúng ghi chữ “ Đ”, kết luận sai ghi chữ “S”:(1 điểm )
| Câu | Nội dung | Đ – S |
| 13.13 | Etilen và Axetilen làm mất màu dung dịch brom vì phân tử có liên kết đôi và liên kết ba, trong đó có liên kết kém bền. | |
| 13.14 | Metan cũng có phản ứng cộng với brom dù phân tử không có liên kết đôi | |
| 13.15 | Etilen cũng có phản ứng thế với Clo giống Metan | |
| 13.16 | Cả metan, etilen và axetilen cháy đều toả nhiều nhiệt |
II. Tự luận (6 điểm)
Câu 14: (2 điểm) Lập PTHH cho sơ đồ sau, ghi điều kiện của phản ứng (nếu có):
C → CO2 →CaCO3 →CO2→ H2CO3
Câu 15: (4 điểm): Đốt cháy hoàn toàn 2,24 lít khí metan.
a. Viết phương trình hoá học của phản ứng.
b. Tính thể tích khí oxi và thể tích khí cacbonic tạo thành (ở đktc).
c. Viết công thức cấu tạo của khí CH4, C2H6, C2H4, C2H2.
Đáp án đề thi giữa kì 2 môn Hóa học lớp 9
I. Trắc nghiệm
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| Đề 100 | B | D | D | A | C | A | C | D | B | C | B | B | Đ | S | S | Đ |
II. Tự luận
Câu 14:
(1) C + O2 →CO2
(2) CO2 + CaO →CaCO3
(3) CaCO3 → CaO + CO2
(4) CO2 + H2O →H2CO3
Ghi chú: Các phản ứng (1,3) không ghi điều kiện trừ 0,25đ cho mỗi pthh
Phản ứng2 có thể dùng Ca(OH)2.
……………
Đề thi giữa kì 2 lớp 9 môn Hóa học – Đề 3
Đề thi giữa học kì 2 môn Hóa học lớp 9
Câu 1: (1.5 điểm) Viết PTHH thực hiện chuỗi phương trình sau:
C2H4 → C2H5OH → CH3COOH →CH3COONa
Câu 2: (2.0 điểm) Hoàn thành bảng sau:
| Liên kết đôi | Mất màu dd Br2 | Phản ứng trùng hợp | Tác dụng với Oxi | |
| Metan (C2H4) |
Câu 3: ( 2.5 điểm) Đốt cháy hoàn toàn 11.2 lít khí Etilen . Hãy tính thể tích khí oxi và thể tích khí CO2 tạo thành (đktc).
Câu 4: (4.0 điểm)
Axit axetic có thể tác dụng với những chất nào sau đây: ZnO, KOH, Cu, Na2SO4, C2H5 Hãy viết phương trình hóa học (nếu có).
a. Cho 14 gam rượu etylic tác dụng với Natri (dư)
b. Tính khối lượng sản phẩm
c. Tính thể tích khí H2(đktc).
Đáp án đề thi giữa kì 2 lớp 9 môn Hóa
| Câu 1
1.5đ |
C2H4 + H2O → C2H5OH (axit x/t)
C2H5OH + O2 → CH3COOH + H2O (Men giấm x/t) 2CH3COOH + 2Na→ (CH3COO)2Na + H2 |
0.5 đ
0.5 đ 0.5 đ (không có điều kiện mỗi PT trừ 0.25đ) |
||||||||||
| Câu 2
2.0đ |
|
|||||||||||
| Câu 3
2.5đ |
C2H4 + 3O2 → 2CO2 + H2O
0.5 1 0.5 Netilen= 0.5 mol Vkhí Oxi = 22.4 (l) VCacbonic = 11.2 (l) |
1.0đ
0.5đ 0.5đ 0.5đ |
||||||||||
| Câu 4
4.0đ |
a.
2CH3COOH + ZnO→ (CH3COO)2Zn + H2O CH3COOH + KOH →CH3COOK + H2O CH3COOH + C2H5OH → CH3COOC2H5 + H2O b. 2 C2H5OH + 2Na → 2CH3COONa + H2 0.3 0.3 0.15 Nrượu etylic = 0.3 mol mmuối = 20.4 gam Vkhí Hidro = 3.36 (l) |
0.5đ
0.5đ 0.5đ 1.0đ 0.5đ 0.5đ 0.5đ |
…………………………………
Đề thi giữa kì 2 lớp 9 môn Hóa học – Đề 4
Ma trận đề kiểm tra giữa kì 2 Hóa 9
| Chủ đề | Nhận biết | Thông hiểu | Vận dụng | Vận dụng nâng cao | ||||||
| TNKQ | TL | TNKQ | TL | TNKQ | TL | TNKQ | TL | |||
| Rượu etylic | 1. Biết độ rượu và cách tính độ rượu
|
|||||||||
| Số câu | 2 câu
C2-1, C8-1 |
1 câu
C9-1 |
||||||||
| Số điểm | 0.5Đ | 2Đ | ||||||||
| Axit axetic | 2. Biết được những tính chất của axit axetic | 3. Tính toán được các bài toán liên quan tới axit axetic | ||||||||
| Số câu | 4 câu
C1-2, C3-2, C6-2, C7-2 |
1 câu
C4-3 |
1 câu
C12-3 |
|||||||
| Số điểm | 1Đ | 0.25Đ | 2Đ | |||||||
| Mối liên hệ giữa các rượu etylic, axit axetic và etilen | 4. Hoàn thành được chuỗi phản ứng hóa học | |||||||||
| Số câu | 1 câu
C10-4 |
|||||||||
| Số điểm | 2Đ | |||||||||
| Chất béo | 5. Biết công thức của chất béo.
|
6. Viết được các phương trình phản ứng | ||||||||
| 1 câu
C5-5 |
1 câu
C11-6 |
|||||||||
| 0.25Đ | 2Đ | |||||||||
| Tổng
Số điểm – % |
8 câu
3.75đ – 37.5% |
2 câu
4đ – 40% |
2 câu
2,25đ – 22.5% |
|||||||
Đề thi giữa kì 2 Hóa 9
I. TRẮC NGHIỆM (2 điểm): Hãy chọn đáp án đúng sau đó ghi vào bảng bên dưới
Câu 1: : Sản phẩm giữa rượu etylic và axitaxetic gọi là
A. ete.
B. este.
C. hợp chất vô cơ.
D. axit.
Câu 2: Số ml nước có trong 100ml rượu 450 là
A. 100ml.
B. 45ml.
C. 55 ml.
D. 145 ml.
Câu 3: Để tác dụng được với kim loại Zn và giải phóng khí hidro thì chất đó là
A. C6H6.
B.CH3COOH.
C. C2H5OH.
D. C2H4.
Câu 4: Để trung hòa 10ml dung dịch CH3COOH cần 15,2 ml dung dịch NaOH 0,2M. Vậy nồng độ của dung dịch CH3COOH là
A. 0,05 M.
B. 0,10 M.
C. 0,304 M.
D. 0,215 M.
Câu 5: Công thức của chất béo là
A. RCOOC3H5.
B. (RCOO)3C3H5 .
C. C3H5(OH)3.
D. R-COOH.
Câu 6: Cho các chất: Mg, CuO, CaCO3, C2H5OH, NaOH, Cu. Số chất tác dụng với axitaxetic là
A. 3.
B.2.
C. 5.
D. 4.
Câu 7: CH3COOC2H5 có tên gọi là:
A.natri axetat .
B.etyl axetat.
C. metyl axetat.
D. axit axetic.
Câu 8: Số ml Rượu Etylic có trong 200ml rượu Etylic 450 là
A. 90ml.
B.225ml.
C. 200ml.
D. 45ml.
II. TỰ LUẬN (8 điểm)
Câu 9: (2 điểm): Độ rượu là gì?
Áp dụng: Tính độ rượu khi hòa tan 50ml rượu etylic vào 250ml nước?
Câu 10: (2 điểm): Hoàn thành chuỗi phản ứng sau và ghi điều kiện phản ứng nếu có?
C2H4 →C2H5OH →CH3COOH →CH3COOC2H5 →CH3COOH
Câu 11: (2 điểm): Hoàn thành phương trình phản ứng sau:
a. C2H5OH + ? →? + H2
b. CH3COOH + →?(CH3COO)2Mg + ?
c. Etyl axetat + NaOH →
d. (RCOO)3 →C3H5+ H2O
Câu 12: (2 điểm): Cho 19,5 gam Zn vào 150g dung dịch axitaxetic12%.
a. Tính thể tích khí hiđro thu được ở ĐKTC?
b. Tính khối lượng chất rắn còn lại sau phản ứng?
(Cho biết Zn = 65; C = 12; H= 1; O = 16)
Đáp án đề kiểm tra giữa kì 2 Hóa 9
I. TRẮC NGHIỆM: (2 điểm)Mỗi câu đúng 0,25 điểm
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | B | B | C | B | C | B | A |
II. TỰ LUẬN : (8 điểm)
| Câu | Trả lời | Điểm |
| 9
(2 điểm) |
Độ rượu là số ml rượu nguyên chất có trong 100ml hỗn hợp rượu và nước.
Hỗn hợp rượu và nước= 50 ml + 250ml = 300ml Trong 300ml hỗn hợp rượu và nước có 50ml rượu nguyên chất Trong 100ml hỗn hợp rượu và nước có rượu nguyên chất Vậy độ rượu là 16,66 |
1 đ
1đ |
| 10
(2 điểm) |
1. C2H4 + H2O →C2H5OH
2. C2H5OH + O2 →CH3COOH + H2O 3. CH3COOH + C2H5OH →CH3COOC2H5 + H2O 4. CH3COOC2H5 + H2O →2CH3COOH + C2H5OH – Mỗi phương trình đạt 0,5 điểm – Không cân bằng hoặc cân bằng sai trừ 0,25 số điểm của mỗi câu. – Viết công thức sai không tính điểm cho câu đó. – Viết phương trình khác nếu đúng đạt điểm tối đa |
0,5 điểm
0,5 điểm
0,5 điểm
0,5 điểm |
………………………..
Đề thi giữa kì 2 môn Hóa học 9 – Đề 5
A. Trắc nghiệm khách quan: (4,0 điểm)
Câu 1. Phản ứng hóa học đặc trưng của metan là:
A. Phản ứng thế.
B. Phản ứng cộng
C. Phản ứng oxi hóa – khử.
D. Phản ứng phân hủy.
Câu 2. Điều kiện để phản ứng giữa Metan và Clo xảy ra là:
A. Có bột sắt làm xúc tác
B. Có axit làm xúc tác
C. Có nhiệt độ
D. Có ánh sáng
Câu 3. Dãy chất nào sau đây đều là hidrocacbon:
A. C2H4, C3H8, C2H4O2, CH3Br
B. C3H8, C2H5O, CH3CH2COOH, CaCO3
C. C2H6, C4H10, CH3NO2, C2H5Cl
D. CH4, C5H12, C2H2, C2H6
Câu 4. Phản ứng nào sau đây thuộc loại phản ứng trùng hợp:
A. C2H4 + 3O2 → 2CO2 + 2H2O
B. CH2 = CH2 + Br2 → BrCH2 – CH2Br
C. nCH2 = CH2 → (-CH2-CH2-)n
D. CH4 + Cl2 → CH3Cl + HCl
Câu 5. Chất nào sau đây có chứa liên kết ba trong phân tử
A. Metan.
B. Etilen.
C. Axetilen.
D. Propan.
Câu 6. Khi cho etilen tác dụng với nước (có xúc tác) thu được
A. Ancol etylic (C2H5OH)
B. Etan (C2H6)
C. Axit axetic (CH3COOH)
D. Etilen oxit (C2H4O)
Câu 7. Khí axetilen không có tính chất hóa học nào sau đây?
A. Phản ứng cộng với dung dịch brom
B. Phản ứng cháy với oxi.
C. Phản ứng cộng với hiđro.
D. Phản ứng thế với clo ngoài ánh sáng.
Câu 8. Đốt cháy một hỗn hợp hiđrocacbon ta thu được 2,24 lít CO2 (đktc) và 2,7 gam H2O thì thể tích O2 đã tham gia phản ứng cháy (đktc) là:
A. 3,92 lít.
B. 2,8 lít.
C. 4,48 lít.
D. 5,6 lít.
Câu 9. Trong phòng thí nghiệm, etilen thường được điều chế bằng cách.
A. nung nóng etan để tách hidro
B. tách từ khí mỏ dầu
C. tách nước của ancol etylic
D. Cracking dầu mỏ
Câu 10: Chất nào sau đây làm mất màu dung dịch Brom
A. metylpropan
B. cacbon đioxit
C. butan
D. but-1-en
Câu 11: Để làm sạch Etilen có lẫn Axetilen ta cho hỗn hợp đi qua dung dịch nào sau đây
A. dung dịch KMnO4 dư.
B. dung dịch brom dư.
C. dung dịch AgNO3/NH3 dư.
D. các cách trên đều đúng.
Câu 12. Đốt cháy V lít etilen thu được 3,6g hơi nước. Biết rằng oxi chiếm 20% thể tích không khí. Vậy thể tích không khí ở đktc cần dùng là:
A. 336 lít
B. 3,36 lít.
C. 33,6 lít
D. 0,336 lít.
B. Tự luận: (7,0 điểm)
Câu 1. (2,0 điểm)
Hoàn thành chuỗi phản ứng hóa học sau:
CH4 → C2H2 → C2H4 → C2H6 → C2H5Cl
Câu 2. (2,5 điểm)
Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X (chứa C, H, O) thu được 11,0 gam CO2 và 6,75 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong X.
b) Lập công thức đơn giản nhất của X.
c) Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với khí hiđro bằng 23.
Câu 3. (1,5 điểm)
Cho 5,6 lít hỗn hợp khí X (đktc) gồm CH4 và C2H4 có tỉ lệ thể tích là 3 : 2 qua dung dịch chứa m gam dung dịch brom 40%. Tìm giá trị m.
Đáp án đề thi giữa kì 2 Hóa 9
A. Trắc nghiệm khách quan (3,0 điểm)
| 1A | 2D | 3D | 4B | 5C | 6A |
| 7D | 8A | 9C | 10D | 11C | 12C |
B. Tự luận (7,0 điểm)
Câu 1.
2CH4 C2H2 + 3H2
C2H2+ H2 C2H4
C2H4 + H2 C2H6
C2H6 + Cl2 → C2H5Cl + HCl
Câu 2.
nC= nCO2 = 0,25 => %C = (0,25 . 12/5,75).100 = 52,17%
nH = 2nH2O = 0,75 => %H = (0,75 .1/5,75). 100 = 13,04%
=> %O = 34,79%
nO = ( mX – mC – mH )/16 = 0,125
X là CxHyOz
=> x : y : z = nC : nH : nO= 0,25 : 0,75 : 0,125 = 2 : 6 : 1
Công thức đơn giản nhất: C2H6O
Công thức phân tử: (C2H6O )n
=> MX = 46n = 23,2
=> n = 1
X là C2H6O
Câu 3.
Gọi số mol CH4 và C2H4 lần lượt là 3a và 2a.
=> nX = 5a = 5,6/22,4 = 0,25 ⟹ a = 0,05 (mol).
Phương trình hóa học phản ứng xảy ra
C2H4 + Br2 ⟶ C2H4Br2
Theo phương trình hóa học ta có:
nBr2 = nC2H4 = 0,05.2 = 0,1 mol.
=> mBr2 = 0,1.160 = 16 gam.
Vậy m = (16.100%)/40% = 40 gam.
…………………………………………
Mời các bạn tải file tài liệu để xem thêm nội dung chi tiết
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Giáo dục