Axit sunfuric H2SO4 cùng với một số axit khác như axit nitrric HNO3 axit Clohidric HCl là những axit có khá nhiều dạng bài tập tương đối ‘khó nhằn’ ngay cả với những bạn yêu thích môn hóa ở bậc THPT.
Đặc biệt đối với axit sunfuric khi phản ứng với các kim loại sẽ tạo ra các sản phẩm khử khác nhau, ví dụ, cùng 1 kim loại khi tác dụng vớiaxit sunfuric loãng (H2SO4 loãng) cho sản phẩm là chất khử khác với axit sunfuric đặc nóng (H2SO4đặc nóng).
This post: Bài tập về Axit Sunfuric H2SO4 (loãng, đặc nóng) có lời giải và đáp án – hóa lớp 10
Vì vậy, trong bài viết này chúng tacùng hệ thống lại một số dạng bài tập về dung dịch axit sunfuric H2SO4(loãng, đặc nóng) và cách giải.
Sơ lược về axit sunfuric với các tính chất hóa học đặc trưng, cách điều chế vào ứng dụng nếu chưa nắm vững kiến thức các em có thể tham khảo ở bài viết sau:
• xem thêm: Tính chất hóa học của Axit Sunfuric H2SO4 điều chế và ứng dụng
– Nội dung bài tập axit sunfuric ngoài việc nhớ tính chất hoá học của axit sunfuric ở các trạng thái loãng, đặc nóng hoặc nguội các em cũng cần nhớ nội dung các định luật bảo toàn khối lượng, bảo toàn nguyên tố và bảo toàn electron,…
I. Dung dịch Axit Sunfuric loãng (H2SO4 loãng) tác dụng với kim loại
1. Phương pháp
– PTPƯ tổng quát: xM + yH2SO4→ Mx(SO4)y + yH2↑
– Theo PTPƯ ta có: 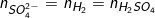 (1)
(1)
– Trường hợp cho m gam hỗn hợp nhiều kim loại tác dụng với dung dịch Axit Sunfuric loãng thu được V lít khí H2 (duy nhất ở ĐKTC) thu được a gam khối lượng muối thì áp dụng định luật bảo toànnguyên tốta có: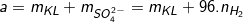 (2)
(2)
2. Bài tập vận dụng kim loại tác dụng vớidung dịchAxit Sunfuric loãng
Bài tập 1:Hoà tan hết 11,1 gam hỗn hợp 3 kim loại trong dung dịch H2SO4loãng dư thu được dung dịch A và 8,96 lít khí ở đktc. Cô cạn dung dịch A thu được m gam muối khan. tính m?
* Lời giải:
– Theo bài ra, nH2 = 8,96/22,4 = 0,4(mol).
– Áp dụng công thức (2) ta có: mmuối=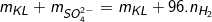
⇒ mmuối= 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5(g).
Bài tập 2:Cho 2,81 gam hỗn hợp gồm 3 oxit Fe2O3 , MgO , ZnO tan vừa đủ trong 300ml dung dịch H2SO40,1M thì thu được mgam muối sunfat khan tạo thành, tính m?
* Lời giải:
– Theo bài ra, nH2SO4 = CM.V = 0,1.0,3 = 0,03(mol)
– Áp dụng công thức (2):mmuối= mKL + mSO42- – mO
⇒mmuối=2,81 + (96-16).0,03 = 2,81 + 2,4 = 5,21(g).
II. Axit Sunfuric đặc nóng (H2SO4 đặc nóng) tác dụng với kim loại hoặc hỗn hợp oxit kim loại
1. Phương pháp:
– PTPƯ tổng quát:M + H2SO4→ Mx(SO4)y+ {SO2 , H2S , S}+ yH2O
– Các sản phẩm khử có thể có của phản ứng: {SO2, H2S , S}
– Lưu ý: Al, Fe, Cr thụ động (không phản ứng) với H2SO4đặc nguội
* Như vậy, ta có:
+ Số mol H2SO4 (môi trường ≡ tham gia tạo muối) = số mol gốc SO42- trong muối Mx(SO4)y = ½(số electron trao đổi x số mol sản phẩm khử)
+ Số mol H2SO4 (đóng vai trò chất oxi hoá≡ tham gia tạo sản phẩm khử ) = số mol nguyên tử S trong sản phẩm khử
+ Tổng số mol H2SO4(tham gia pư) = số mol H2SO4 (môi trường) + số mol H2SO4(đóng vai trò chất oxi hoá)
* Cụ thể:
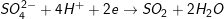
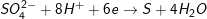
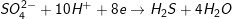
a) Tính khối lượng của muối:
mmuối= mKL pư+ mSO42-trong muối
mSO42-trong muối=½(6ns+ 2nSO2+ 8nH2S).96
mmuối = mKL pư +½(6ns + 2nSO2 + 8nH2S).96
– Lưu ý: sản phầm khử nào không có trong phản ứng thì số mol=0
b) Tính số mol axit phản ứng
nH2SO4 = 4nS + 2nSO2+ 5nH2S
– Lưu ý: sản phầm khử nào không có trong phản ứng thì số mol=0
c) Tìm sản phẩm khử
A+ H2SOađặc→ A2(SO4)a+ sp khử Sx(SO2, S, H2S)
B + H2SOa đặc→ B2(SO)b + sp khử Sx(SO2 , S, H2S)
C + H2SOađặc→ C2(SO4)c+ sp khử Sx(SO2, S, H2S)
– Áp dụng định luật bảo toàn electron ta có (với a,b,c là số electron kim loại nhường):
a.nA + b.nB + c.nC =6ns+ 2nSO2+ 8nH2S
– VớiiKL = số oxi hóa cao nhất của kim loại, thì
iA.nA+ iB.nB+ iC.nC= (6-x).nspk
(ispk = (6-x)⇐ iSO2 = 2;iS= 6;iH2S= 8)
2. Bài tập vận dụng kim loại (oxit kim loại) tác dụng axit sunfuric đặc nóng
Bài tập 1:Cho 15,82 gam hỗn hợp Al, Fe, Cu tác dụng hết với dung dịch H2SO4đặc nóng thu được dung dịch A và 9,632 lít khí SO2 ở đktc. Cô cạn dung dịch A sẽ thu được số m gam muối khan, tìm m?
* Lời giải:
– Theo bài ra, nSO2 = 9,632/22,4 = 0,43(mol).
– Áp dụng công thức trên ta có:mmuối= mKL pư+½(2nSO2).96
⇒mmuối=15,82 + (½)2.0,43.96 =15,82 +41,28 = 57,1(g).
Bài tập 2:Cho 13,428 gam một kim loại M tác dụng với dung dịch H2SO4đặc nóng dư thu được V lít khí H2S ở đktc và dung dịch A. Cô cạn dung dịch A thu được 66,24 gam muối khan.Tìm V?
* Lời giải:
– Áp dụng công thức: nH2S =¼.nSO42-trong muối
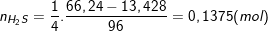
⇒ VH2S = 0,1375.22,4 = 3,0807 (lít).
Bài tập 3: Cho 18 gam kim loại M tác dụng với dung dịch H2SO4đặc nóng dư thu được 3,36 lít khí SO2(ở đktc) 6,4 gam S và dung dịch X. Cô cạn dung dịch X thu được số m gam muối khan, tính m?
* Lời giải:
– Theo bài ra: nSO2 = 3,36/22,4 = 0,15(mol); nS = 6,4/32 = 0,2(mol).
– Ta có: nSO42-trong muối=½(6ns+ 2nSO2) = nSO2 + 3nS = 0,15 + 3.0,2 = 0,75(mol).
– Áp dụng công thức:mmuối= mKL pư+ mSO42-trong muối= 18 + 0,75.96 =90(g).
Bài tập 4: Hoà tan hoàn toàn 12,9 gam hỗn hợp A gồm Zn và một kim loại M hoá trị II vào dung dịch H2SO4đặc thu được 4,144 lít (đktc) hỗn hợp gồm SO2 và H2S có tỉ khối so với hiđro bằng 31,595. Tìm số mol axit H2SO4đặc đã phản ứng.
* Lời giải:
– Gọi x, y lần lượt là số mol SO2 và H2S
– Theo bài ra, ta có:x+ y= 4,144/22,4 = 0,185(mol). (*)
– Tỉ khối so với H2= 31,595, ta có: 64x + 34y = 2(x+y).31,595 = 63,19(x+y)
⇒ 64x – 63,19x + 34y – 63,19y = 0
⇒ 0,81x – 29,19y = 0 (**)
– Giải hệ (*) và (**) ta được: x = 0,18(mol); y = 0,005(mol)
– Áp dụng công thức:nH2SO4= 2nSO2+ 5nH2S = 2.0,18 + 5.0,005 = 0,385(mol).
Bài tập 5:Cho 45 gam hỗn hợp Zn và Cu tác dụng vừa đủ với dung dịch H2SO4đặc nóng 98% thu được 15,68 lít khí SO2(đktc). Tính khối lượng dung dịch H2SO4đã dùng?
* Lời giải:
– Theo bài ra, ta có: nSO2= 15,68/22,4 = 0,7(mol).
– Áp dụng công thức:nH2SO4= 2nSO2= 2.0,7 = 1,4(mol).
– Từ công thức tính C% H2SO4ta có: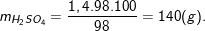
Bài tập 6:Cho 2,52 gam hỗn hợp gồm Al và Mg trộng theo tỉ lệ mol là 2:3 tác dụng với dung dịch H2SO4đặc thì thu được muối sunfat và 0,03 mol một chất khử duy nhất chứa lưu huỳnh. Xác định sản phẩm khử?
* Lời giải:
– Gọi x và y là số mol của Al và Mg trong 2,52g hỗn hợp, ta có: 27x + 24y = 2,52 (1)
– Tỉ lệ mol là 2:3 nên ta có: x/y = 2/3⇒ 3x = 2y (2)
– Giải hệ pt (1) và (2) ta được: x = 0,04(mol); y = 0,06(mol).
⇒ nAl= 0,04 và nMg= 0,06(mol)
– Gọi a là số oxi hoá của lưu huỳnh S trong chất khử thu được, áp dụng công thức:
iA.nA+ iB.nB+ iC.nC=6ns+ 2nSO2+ 8nH2S
⇔ 3.0,04 + 2.0,06 = 0,03(6-a)
⇔ a = -2⇒ Vậy chất khử là H2S
Bài tập 7:Cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4đặc thấy có 49 gam axit phản ứng thu được muối, sản phẩm khử X và nước. Xác định X?
* Lời giải:
– Theo bài ra, ta có: nMg= 9,6/24 = 0,4(mol), nH2SO4= 49/98 = 0,5(mol).
⇒ nSO42-muối= nMg= 0,4(mol)⇒ nS(sp khử)= 0,5 – 0,4 = 0,1(mol).
– Gọi a là số oxi hoá của lưu huỳnh S trong chất khử thu được, áp dụng công thức:
2.nMg= nS(6-a)⇔2.0,4 = 0,1(6-a)⇔ a = -2
⇒ Vậy sản phẩm khử là: H2S
III. Một số bài tập luyện tập về Axit sunfuric
Câu1: (Đề tuyển sinh ĐH- khối A-2007) Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml dung dịch H2SO40,1M vừa đủ. Cô cạn dung dịch sau phản ứng thì thu được số gam muối khan là:
A.6,81 gam B. 4,81 gam C. 3,81 gam D. 5,81 gam
Câu 2: Hoà tan hết 1,72 gam hỗn hợp kim loại gồm Mg, Al, Zn, Fe bằng dung dịch H2SO4loãng thu được V lít khí ở đktc và 7,84 gam muối sunfat khan. Giá trị của V là:
A. 1,344 lít B. 1,008 lít C. 1,12 lít D. 3,36 lít
Câu 3: Hoà tan hết hỗn hợp X gồm Fe và 0,24 mol kim loại M trong dung dịch H2SO4loãng dư thu được dung dịch A và 10,752 lít khí H ở đktc. Cô cạn dung dịch A thu được 59,28 gam muối khan. M là :
A. Mg B. Ca C. Al D. Na
Câu 4: Cho 21 gam hỗn hợp 3 kim loại Fe, Zn, Al tan hoàn toàn trong dung dịch H2SO40,5M thu được 6,72 lít khí H2 (đo ở 00C và 2atm). Khối lượng muối khan thu được sau khi cô cạn dung dịch và thể tích dung dịch axit tối thiểu cần dùng là:
A. 78,6gam và 1,2 lít B. 46,4gam và 2,24lít
C. 46,4gam và 1,2 lít D. 78,6gam và 1,12 lít
Câu 5: Hoà tan hỗn hợp A gồm 16,8 gam Fe, 2,7 gam Al, 5,4 gam Ag tác dụng với dung dịch H2SO4đặc nóng chỉ thoát ra khí SO2. Số mol H2SO4 tác dụng là :
A. 0,95 mol B. 0,9 mol C. 1,25 mol D. 0,85 mol
Câu 6: Hỗn hợp X gồm 2 kim loại Cu và Ag. Hoà tan hoàn toàn m gam hỗn hợp X trong dung dịch chứa 2 axit HNO3, H2SO4 thu được dung dịch Y chứa 7,06 gam muối và hỗn hợp khí Z chứa 0,05 mol NO2 và 0,01 mol SO2. Giá trị của m là :
A. 2,85 gam B. 3,32 gam C. 3,00 gam D. 0,85 gam
Câu 7: Cho M là kim loại hoá trị II. Cho m gam M tác dụng với dung dịch H2SO4 đặc nóng dư thu được 0,672 lít khí có tỷ khối so với amoniac là 2 và dung dịch A. Cô cạn dung dịch A thu được 14,4 gam muối khan . M là :
A. Ca B. Mg C. Zn D. Ba
Câu 8: Cho m gam hỗn hợp gồm 2 kim loại tác dụng với H2SO4 đặc nóng dư thu được 3,36 lít khí SO2 (đktc); 2,88 gam S và dung dịch X. Cô cạn dung dịch X thu được 52,8 gam muối khan. Mặt khác nếu hoà tan hết m gam hỗn hợp kim loại ban đầu với dung dịch HCl dư thu được 8,064 lít khí H ở đktc. Hỗn hợp 2 kim loại đầu là:
A. Be và Mg B. Mg và Fe C. Zn và Fe D. Zn và Ba
Câu 9: Hoà tan 6,4 gam Cu bằng axit H2SO4 đặc, nóng (dư), sinh ra V lít khí SO2(sản phẩm khử duy nhất, ở đktc). Tính V?
A. 2,24 lít B. 1,12 lít C. 4,48 lít D. 2,56 lít
Câu 10: Cho m gam Fe tác dụng hoàn toàn với dung dịch H2SO4đặc, nóng (dư) thu được 72 lít khí SO2 (ở đktc). Tính m?
A. 11,2 gam B. 2,24 gam C. 5,6 gam D.1,12 gam
* Đáp án:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | C | A | C | C | B | B | A | A |
Hy vọng với phần hệ thống một số bài tậpAxit Sunfuric H2SO4 (loãng, đặc nóng) có lời giải và đáp án ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt!
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức





