A. Natri hiđroxit
Giải bài 1 trang 27 SGK Hóa 9
Bài 1:Có 3 lọ không nhãn, mỗi lọ đựng một chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
Lấy mẫu thử từng chất và đánh số thứ tự. Hòa tan các mẫu thử vào H2O rồi thử các dung dịch:
– Dùng quỳ tím cho vào từng mẫu thử
+ Mẫu nào làm quỳ tím hóa xanh đó là NaOH và Ba(OH)2.
+ Còn lại là NaCl không có hiện tượng.
– Cho H2SO4vào các mẫu thử NaOH và Ba(OH)2
+ Mẫu nào có kết tủa trắng đó là sản phẩm của Ba(OH)2
PTHH: Ba(OH)2+ H2SO4→ BaSO4↓ trắng + 2H2O
+ Còn lại là NaOH.
Giải bài 2 trang 27 SGK Hóa 9
Bài 2:Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl. Hãy chọn những chất thích hợp điền vào sơ đồ phản ứng sau và lập phương trình hóa học.
a)… → Fe2O3+ H2O
b)H2SO4+ … → Na2SO4+ H2
c)H2SO4+ … → ZnSO4+ H2O
d)NaOH + … → NaCl + H2O
e)… + CO2→ Na2CO3+ H2O.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
a)2Fe(OH)3→ Fe2O3+ 3H2O
b)H2SO4+ 2NaOH → Na2SO4+ 2H2O
c)H2SO4+ Zn(OH)2→ ZnSO4+ 2H2O
d)NaOH + HCl → NaCl + H2O
e)2NaOH + CO2→ Na2CO3+ H2O.
Giải bài 3 trang 27 SGK Hóa 9
Bài 3:Dẫn từ từ 1,568 lít khí CO2(đktc) vào một dung dịch có hòa tan 6,4g NaOH.
a)Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
b)Hãy xác định muối thu được sau phản ứng.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
a) Trước tiên ta phải xem muối nào được tạo thành (NaHCO3hay Na2CO3).
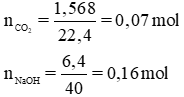
nNaOH> 2nCO2nên muối sau phản ứng là Na2CO3; CO2phản ứng hết, NaOH dư.
Phương trình hóa học của phản ứng :
2NaOH + CO2→ Na2CO3+ H2O
Theo pt nNaOH pư= 2.nCO2= 2. 0,07 = 0,14 mol ⇒ nNaOH dư= 0,16 – 0,14 = 0,02 mol
Khối lượng chất dư sau phản ứng:
mNaOH= 0,02 . 40 = 0,8g.
b)Theo pt nNa2CO3= nCO2= 0,07 mol
⇒ mNa2CO3= 0,07 x 106 = 7,42g.
(Lưu ý cách xác định sản phẩm muối tạo thành sau phản ứng:
Đặt tỉ lệ
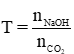
Nếu T ≥ 2 ⇒ Chỉ tạo muối Na2CO3; Khi T = 2 phản ứng vừa đủ, T > 2 NaOH dư
Nếu T ≤ 1 ⇒ Chỉ tạo muối NaHCO3; Khi T = 2 phản ứng vừa đủ, T 2dư
Nếu 1
B. Canxi hiđroxit
Giải bài 1 trang 30 SGK Hóa 9
Bài 1:Viết các phương trình hóa học thực hiện các chuyển đổi hóa học sau:
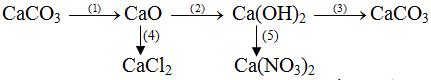
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
Phương trình hóa học của các phản ứng:
(1)CaCO3−to→CaO + CO2
(2)CaO + H2O → Ca(OH)2
(3)Ca(OH)2+ CO2→ CaCO3+ H2O
(4)CaO + 2HCl → CaCl2+ H2O
(5)Ca(OH)2+ 2HNO3→ Ca(NO3)2+ 2H2O
Giải bài 2 trang 30 SGK Hóa 9
Bài 2:Có ba lọ không nhãn, mỗi lọ đựng một trong ba chất rắn màu trắng sau: CaCO3, Ca(OH)2, CaO. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình hóa học.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
Lấy mỗi chất rắn 1 ít làm mẫu thử và đánh số thứ tự
– Cho ba chất rắn vào nước:
+ Chất nào không tan trong nước đó là CaCO3.
+ Chất nào phản ứng với nước làm nóng ống nghiệm là CaO
PTHH: CaO + H2O → Ca(OH)2
+ Chất chỉ tan 1 phần tạo chất lỏng màu trắng và có 1 phần kết tủa lắng dưới đáy là Ca(OH)2
Giải bài 3 trang 30 SGK Hóa 9
Bài 3:Hãy viết các phương trình hóa học khi cho dung dịch NaOH tác dụng với dung dịch H2SO4tạo ra:
a) Muối natri hiđrosunfat.
b) Muối natri sunfat.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
a) Muối natri hidrosunfat: NaHSO4
H2SO4+ NaOH → NaHSO4+ H2O
b) Muối natri sunfat: Na2SO4
H2SO4+ 2NaOH → Na2SO4+ 2H2O
Giải bài 4 trang 30 SGK Hóa 9
Bài 4:Một dung dịch bão hòa khí CO2trong nước có pH = 4. Hãy giải thích và viết phương trình hóa học của CO2với nước.
Lời giải:
This post: Bài 8- Một số bazơ quan trọng
Dung dịch bão hòa CO2trong nước tạo ra dung dịch axit cacbonic (H2CO3) là axit yếu, có pH = 4.
CO2+ H2O ⇌ H2CO3.
Hóa học 9 Bài 8: Một số bazơ quan trọng
I. NATRI HIĐROXIT(công thức hóa học NaOH)
1. Tính chất vật lí
– Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
– Dung dịch NaOH có tính nhờn, làm bục vải giấy và ăn mòn da. Khi sử dụng NaOH phải hết sức cẩn thận!
2. Tính chất hóa học
Natri hiđroxit có đầy đủ tính chất của một bazơ tan (kiềm).
a. Làm đổi màu chất chỉ thị.
Dung dịch NaOH làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b. Tác dụng với axit tạo thành muối và nước(phản ứng trung hòa)
Ví dụ:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4→ Na2SO4+ 2H2O
c. Tác dụng với oxit axit tạo thành muối và nước
Ví dụ:
2NaOH + CO2→ Na2CO3+ H2O
2NaOH + SO2→ Na2SO3+ H2O
Chú ý:Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư+ Na2CO3+ H2O → 2NaHCO3
SO2 dư+ Na2SO3+ H2O → 2NaHSO3
d. Tác dụng với dung dịch muối.
Dung dịch NaOH có thể tác dụng được với nhiều dung dịch muối.
Ví dụ:
2NaOH + CuSO4→ Na2SO4+ Cu(OH)2↓
3. Ứng dụng
Natri hiđroxit có nhiều ứng dụng trong đời sống và trong công nghiệp. Nó được dùng trong:
– Sản xuất xà phòng, chất tẩy rửa, bột giặt.
– Sản xuất giấy, tơ nhân tạo, trong chế biến dầu mỏ.
– Sản xuất nhôm (làm sạch quặng nhôm trước khi sản xuất).
– Chế biến dầu mỏ và nhiều ngành công nghiệp hóa chất khác.
4. Sản xuất natri hiđroxit
Trong công nghiệp, NaOH được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa. Thùng điện phân có màng ngăn giữa cực âm và cực dương.
II. CANXI HIĐROXIT(công thức hóa học Ca(OH)2)
Dung dịch canxi hiđroxit có tên thông thường là nước vôi trong.
1. Tính chất hóa học Ca(OH)2
Dung dịch Ca(OH)2có tính chất hóa học của một bazơ tan.
a) Làm đổi màu chất chỉ thị
Dung dịch Ca(OH)2làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b) Tác dụng với axit
Ca(OH)2tác dụng với axit, sản phẩm là muối và nước (phản ứng trung hòa)
Ví dụ:
Ca(OH)2+ 2HCl → CaCl2+ 2H2O
Ca(OH)2+ H2SO4→ CaSO4+ H2O
c) Tác dụng với oxit axit
Dung dịch Ca(OH)2tác dụng với oxit axit sản phẩm là muối và nước
Ví dụ:
Ca(OH)2+ CO2→ CaCO3↓ + H2O
Ca(OH)2+ SO2→ CaSO3+ H2O
Chú ý:Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2dư + CaCO3+ H2O → Ca(HCO3)2
SO2dư + CaSO3+ H2O → Ca(HSO3)2
Ngoài ra dung dịch canxi hiđroxit còn tác dụng được với nhiều dung dịch muối.
2. Ứng dụng
Canxi hiđroxit có nhiều ứng dụng. Nó được dùng để:
– Làm vật liệu trong xây dựng.
– Khử chua đất trồng trọt.
– Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật…
III. Thang PH
Thang pH để biểu thị độ axit, độ bazơ của dung dịch:
– Nếu pH = 7: Dung dịch là trung tính.
Ví dụ: nước cất có pH = 7.
– Nếu pH
– Nếu pH > 7: Dung dịch có tính bazơ, pH càng lớn độ bazơ của dung dịch càng lớn.
Bài tập Trắc nghiệm Hóa học 9 Bài 8 (có đáp án): Một số bazơ quan trọng
Câu 1:Thuốc thử để nhận biết dung dịch Ca(OH)2là
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Hiển thị đáp án
Đáp án: A.
Ca(OH)2+ Na2CO3→ CaCO3↓ + 2NaOH
Câu 2:Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Hiển thị đáp án
Đáp án: C.
Các dung dịch bazơ (NaOH; Ca(OH)2…) có pH > 7.
Câu 3:Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO41M thì dung dịch tạo thành sau phản ứng sẽ:
A. Làm quỳ tím chuyển đỏ
B. Làm quỳ tím chuyển xanh
C. Làm dung dịch phenolphtalein không màu chuyển đỏ.
D. Không làm thay đổi màu quỳ tím.
Hiển thị đáp án
Đáp án: D
nNaOH= 0,2.1 = 0,2 mol; số mol H2SO4= 0,1.1 = 0,1 mol
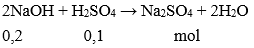
Theo PTHH, sau phản ứng NaOH và H2SO4đều hết, dung dịch thu được Na2SO4không làm đổi màu quỳ tím.
Câu 4:Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
A. Fe(OH)3, BaCl2, CuO, HNO3.
B. H2SO4, SO2, CO2, FeCl2
C. HNO3, HCl, CuSO4, KNO3
D. Al, MgO, H3PO4, BaCl2
Hiển thị đáp án
Đáp án: B
Câu 5:Dung dịch Ca(OH)2phản ứng với tất cả các chất trong dãy chất nào sau đây?
A. NaCl, HCl, Na2CO3, KOH
B. H2SO4, NaCl, KNO3, CO2
C. KNO3, HCl, KOH, H2SO4
D. HCl, CO2, Na2CO3, H2SO4
Hiển thị đáp án
Đáp án: D
Câu 6:Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl
B. Nước vôi trong
C. Dung dịch HCl
D. Dung dịch NaNO3
Hiển thị đáp án
Đáp án: B
Câu 7:Cặp chất đều làm đục nước vôi trong Ca(OH)2là
A. CO2, Na2O.
B. CO2, SO2.
C. SO2, K2O
D. SO2, BaO.
Hiển thị đáp án
Đáp án: B.
Ca(OH)2+ CO2→ CaCO3↓ + H2O
Ca(OH)2+ SO2→ CaSO3+ H2O
Câu 8:Cho 2,24 lít khí CO2( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2cần dùng là:
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
Hiển thị đáp án
Đáp án: A
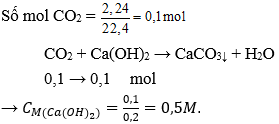
Câu 9:Trung hòa 200 ml dung dịch NaOH 1M bằng dung dịch H2SO410%. Khối lượng dung dịch H2SO4cần dùng là:
A. 98 g
B. 89 g
C. 9,8 g
D. 8,9 g
Hiển thị đáp án
Đáp án: A
nNaOH= 0,2.1 = 0,2 mol
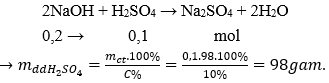
Câu 10:Hòa tan 6,2 gam Na2O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,1M
B. 0,2 M
C. 0,3M
D. 0,4M
Hiển thị đáp án
Đáp án: A
Số mol Na2O = 6,2 : 62 = 0,1 mol
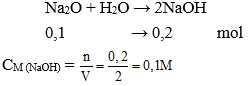
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức





