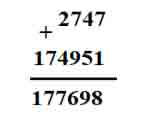Al + H2O + NaOH → NaAlO2 + H2 là phản ứng hóa học, được Mầm Non Ánh Dương biên soạn, phương trình này sẽ xuất hiện xuyên suốt trong quá trình học Hóa học của các bạn. Đặc biệt Hóa học 12 bài Nhôm và hợp chất của nhôm
Hy vọng qua tài liệu này có thể giúp các bạn viết và cân bằng phương trình một cách nhanh và chính xác.
This post: Al + H2O + NaOH → NaAlO2 + H2
1. Phương trình phản ứng Al tác dụng với NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
2. Điều kiện phản ứng Al tác dụng với dung dịch NaOH
Nhiệt độ: Từ 400oC – 500oC
3. Phương trình ion rút gọn khi cho Al tác dụng NaOH
Phương trình phân tử
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Phương trình ion rút gọn
2Al + 2H2O + 2OH– → 2AlO2– + 3H2
4. Cách tiến hành phản ứng cho Al tác dụng NaOH
Cho đồng Al tác dụng với dung dịch bazo NaOH
5. Hiện tượng Hóa học
Kim loại Al tan dần trong dung dịch và xuất hiện bọt khí, khí thoát ra chính là hidro H2
6. Tính chất hóa học của nhôm
a. Tác dụng với oxi và một số phi kim.
4Al + 3O2 → 2Al2O3
ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
b. Nhôm tác dụng với axit (HCl, H2SO4 loãng,..)
- Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
c. Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
d. Tính chất hóa học riêng của nhôm.
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
e. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3 + 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
7. Bài tập vận dụng liên quan
Câu 1. Cho 2,7 gam Al tan hoàn toàn trong dung dịch NaOH, sau phản ứng thu được V lít thoát ra. Giá trị của V ở điều kiện tiêu chuẩn là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
nAl = 0,1 mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 mol → 0,15 mol
VH2 = 0,15.22,4 = 3,36 lít
Câu 2. Rót 100ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
A. 3,9 gam
B. 1,95 gam
C. 7,8 gam
D. 11,7 gam
nNaOH = 0,35 mol
nAlCl3 = 0,1 mol
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
=> NaOH dư 0,05 mol. Tạo 0,1 mol Al(OH)3
Vì dư kiềm nên Al(OH)3 tan 1 phần
Al(OH)3 + NaOH → NaAlO2+ 2H2O
=> nAl(OH)3 tan= 0,05 mol
=> nAl(OH)3 dư= 0,1 – 0,05= 0,05 mol
=> mAl(OH)3 dư= 3,9g
Câu 3. Cho Al (z = 13), vị trí của Al trong bảng tuần hoàn là
A. ô 13, chu kỳ 3, nhóm IIIA.
B. ô 13, chu kỳ 3, nhóm IIIB.
C. ô 13, chu kỳ 3, nhóm IB.
D. ô 13, chu kỳ 3, nhóm IA.
Câu 4. Nhận định không chính xác về nhôm là:
A. Nhôm là kim loại nhẹ, dễ dát mỏng.
B. Nhôm là kim loại có tính khử tương đối mạnh.
C. Trong công nghiệp, nhôm được điều chế bằng phương pháp điện phân nóng chảy.
D. Nhôm có thể khử được các oxit của kim loại kiềm.
Câu 5. Cho các nhận định sau, nhận định nào đúng
(1) Nhôm là chất rắn màu trắng, nhẹ, có ánh kim
(2) Nhôm dẫn điện , dẫn nhiệt kém
(3) Nhôm dễ dát mỏng, kéo sợi
(4) Nhôm dẫn nhiệt tốt nên được dùng làm nồi, xoong nấu ăn
(5) Điều chế nhôm bằng phương pháp điện phân nóng chảy
A. (1), (2), (3)
B. (1), (3), (4), (5)
C. (3),(4),(5)
D. (2), (4), (5)
1) Nhôm là chất rắn màu trắng, nhẹ, có ánh kim => đúng
(2) Nhôm dẫn điện , dẫn nhiệt kém => sai
(3) Nhôm dễ dát mỏng, kéo sợi => đúng
(4) Nhôm dẫn nhiệt tốt nên được dùng làm nồi, xoong nấu ăn => đúng
(5) Điều chế nhôm bằng phương pháp điện phân nóng chảy => đúng
Câu 6. Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng
A. Sục CO2 dư vào dung dịch X thu được a mol kết tủa.
B. Dung dịch X không phản ứng với dung dịch CuSO4.
C. Thêm 2a mol HCl vào dung dịch X thu được 2a/3 mol kết tủa.
D. Dung dịch X làm quỳ tím chuyển sang màu đỏ.
Câu 7. Hòa tan m gam hỗn hợp X gồm Al và Na có tỉ lệ mol 1:2 vào nước dư thu được 4,48 lít khí (đktc). Giá trị của m là
A. 5,84.
B. 6,15.
C. 7,30.
D. 3,65.
Gọi nAl = x (mol)
=> nNa = 2x (mol)
nH2 = 4,48 :22,4 = 0,2 (mol)
Phương trình hóa học
Na + H2O → NaOH + 0,5H2↑
2x → x (mol)
Al + NaOH + H2O → NaAlO2 + 1,5H2↑
x → 1,5x (mol)
Vì Na : Al có tỉ lệ 1: 2 nên cả Na và Al cùng phản ứng hết
=> nH2 = x + 1,5x = 0,2
=> x = 0,08 (mol)
=> m = 0,08.27 + 2.0,08.23 = 5,84 (g)
Câu 8. Dãy chất nào dưới đây tác dụng với nhôm (dạng bột) là:
A. O2, dung dịch Ba(OH)2, dung dịch HCl.
B. Dung dịch Na2SO4, dung dịch NaOH, Cl2
C. H2, I2, dung dịch HNO3 đặc nguội, dung dịch FeCl3
D. Dung dịch FeCl3, H2SO4 đặc nguội, dung dịch KOH
Câu 9. Dãy các chất nào sau đây khi phản ứng với HNO3 đặc nóng đều tạo khí:
A. Cu(OH)2, FeO, C
B. Fe3O4, C, FeCl2
C. Na2O, FeO, Ba(OH)2
D. Fe3O4, C, Cu(OH)2
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
C + 4HNO3 → CO2 + 4NO2 + 2H2O
3FeCl2 + 10HNO3 → 3Fe(NO3)3 + NO + 2H2O + 6HCl
Câu 10. Dung dịch HNO3 đặc, không màu, để ngoài ánh sáng lâu ngày sẽ chuyển thành:
A. Màu vàng.
B. Màu đen sẫm.
C. Màu trắng sữa.
D. Màu nâu.
Câu 11. Chọn nhận định sai:
A. HNO3 là chất lỏng, không màu, tan có giới hạn trong nước.
B. N2O5 là anhiđrit của axit nitric
C. Dung dịch HNO3 có tính oxi hoá mạnh do có ion NO3–
D. HNO3 là axit mạnh.
Câu 12. Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước
2Al + 6H2O → 2 Al(OH)3 + 3H2
Câu 13. Thực hiện các thí nghiệm sau :
(a) Cho từ từ NaOH đến dư vào dung dịch Al2(SO4)3,
(b) Cho từ từ Al2(SO4)3 đến dư vào dung dịch NaOH,
(c) Cho từ từ NH3 đến dư vào dung dịch Al2(SO4)3,
(d) Cho từ từ Al2(SO4)3 đến dư vào dung dịch NH3.
(e) Cho từ từ HCl đến dư vào dung dịch NaAlO2.
(f) Cho từ từ NaAlO2 đến dư vào dung dịch HCl
(g) Cho từ từ Al2(SO4)3 đến dư vào dung dịch NaAlO2
Trong các thí nghiệm trên, số thí nghiệm xuất hiện kết tủa là
A. 2.
B. 3.
C. 5.
D. 7.
a) Xuất hiện kết tủa màu trắng, lượng kết tủa tăng dần đến cực đại và sau đó kết tủa tan ra cho đến hết, dung dịch trở nên trong suốt.
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4;
Al(OH)3 + NaOH → NaAlO2 + 2H2O.
b) Xuất hiện kết tủa màu trắng
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
c)Có kết tủa keo trắng xuất hiện.
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
d)Có kết tủa keo trắng xuất hiện.
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
e) Ban đầu: NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl.
Sau đó, Al(OH)3 ↓ + 3HCl → AlCl3 + 3H2O
f) Có kết tủa trắng xuất hiện
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
g) Có kết tủa trắng xuất hiện
Al2(SO4)3 + 6NaAlO2 + 12H2O → 8Al(OH)3 + 3Na2SO4
Câu 14: Cho m gam hỗn hợp X gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng với 180 ml dung dịch Al2(SO4)3 1M thu được 15,6 gam kết tủa; khí H2 và dung dịch A. Nếu cho m gam hỗn hợp X tác dụng với 240 gam dung dịch HCI 18,25% thu được dung dịch B và H2. Cô cạn dung dịch B thu được 83,704 gam chất rắn khan. Biết rằng m < 45 gam. Phần trăm khối lượng của kim loại kiềm có nguyên tử khối nhỏ hơn trong X là:
A. 48,57%.
B. 37,10%.
C. 16,43%.
D. 28,22%.
Đặt công thức chung của 2 kim loại là X : nAl3+ = 0,36 mol; nAl(OH)3 = 0,2 mol
Trường hợp 1: OH- phản ứng với Al3+ dư:
nOH– = 3n↓ = 0,6 = nX
Trường hợp 2: OH- dư phản ứng Al3+
nOH– = 3nAl3+ + (nAl3+ – n↓) = 1,24 = nX
Nếu nX = 0,6 < nHCl ⇒ 83,704 gam muối XCl
⇒ nCl– = 0,6 mol hay mCl- = 21,3 gam ⇒ mX = 62,404 gam > 45(loại)
Nếu nX = 1,24 mol > nHCl ⇒ 83,704 gam gồm muối XCl (1,2 mol) và XOH (0,04 mol)
⇒ mX = 40,424 < 45 . Ta có: X = 32,6
Hai kim loại kiềm là Na và K
Tính được số mol Na và K lần lượt là 0,496 và 0,744
%mNa = 28,22%
Câu 15. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hidroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
Al3+ tạo kết tủa keo trắng Al3++ 3NH3 + 3H2O → Al(OH)3 + 3NH4+
Zn2+ tạo kết tủa tan trong NH3 dư, Zn2+ + 2NH3 + 2H2O → Zn(OH)2 + 2NH4+
Zn(OH)2 + 4NH3 → (Zn(NH3)4)(OH)2
Câu 16. Câu nào dưới đây nói đúng về tính chất vật lí của nhôm
A. Màu trắng bạc, nhẹ, có ánh kim, dẫn điện và dẫn nhiệt tốt.
B. Màu trắng bạc nặng, có ánh kim, dẫn điện và dẫn nhiệt tốt.
C. Màu trắng xám, nhẹ, có ánh kim, dẫn điện và nhiệt kém.
D. Màu trắng xám, nặng, có ánh kim, dẫn điện và nhiệt kém.
Câu 17. Cho 0,51 gam oxit của một kim loại có công thức là M2O3 tác dụng vừa đủ 300 ml dung dịch HCl 0,1M. Công thức oxit đó.
A. Fe2O3
B. Al2O3
C. Cr2O3
D. Mn2O3
nHCl = 0,3.0,1 = 0,03 mol
M2O3 + 6HCl → 2MCl3 + 3H2O
x mol 6 mol
Ta có: 6x = 0,03 => x = 0,005 mol
=> MM2O3 = 0,51/0,005 = 102 (g/mol) => MM = (102 – 3.12)/2 = 27 (g/mol)
Câu 18. Thả một mẩu nhôm vào ống nghiệm chứa dung dịch CuSO4. Sau phản ứng quan sát được hiện tượng gì:
A. Không có dấu hiệu phản ứng.
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi màu
Phương trình phản ứng
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
→ Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
Câu 19. Cho 700 ml dung dịch KOH 0,1M vào 100 ml dung dịch AlCl3 0,2M. Sau phản ứng khối lượng kết tủa tạo ra là:
A. 0,78 (g)
B. 1,56 (g)
C. 0,39 (g)
D. 0,26 (g)
Theo bài ra ta có: nKOH = 0,7.0,1 = 0,07 (mol);
nAlCl3 = 0,1.0,2 = 0,02 (mol).
Ta có phương trình phản ứng:
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Ban đầu: 0,02 0,07 mol
Phản ứng: 0,02 0,06 0,02 0,06
Sau phản ứng: 0 0,01 0,02 0,06
Vì vậy KOH còn dư nên ta có phản ứng:
Al(OH)3 + KOH → 2H2O + KAlO2
Ban đầu: 0,02 0,01
Phản ứng: 0,01 ← 0,01
Sau phản ứng: 0,01 0 0,01
Vậy sau khi xảy ra phản ứng hoàn toàn, ta có:
nKAlO2 = 0,01 (mol) và nAl(OH)3 = 0,01 (mol)
⇒ mAl(OH)3 = 0,01.78 = 0,78 (g).
Câu 20. Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lit của dung dịch NaOH biết các phản ứng xảy ra hoàn toàn.
A. 0,12M
B. 0,12M hoặc 0,92M
C. 0,92M
D. 0,15M hoặc 0,92M
nAl3+ = 0,12 mol; n↓ = 0,02 mol.
Ta thấy n↓ < nAl3+ và bài không yêu cầu tính lượng NaOH là min hay max nên có 2 trường hợp xảy ra:
Trường hợp 1: Chỉ tạo kết tủa và Al3+ còn dư, khi đó chỉ xảy ra phản ứng tạo kết tủa.
Al3+ + 3OH- → Al(OH)3
0,06 → 0,02
=> [NaOH] = 0,12M.
– TH2: Kết tủa sinh ra và bị hòa tan một phần.
n↓còn lại = 4nAl3+ – nOH– → nOH– = 4nAl3+ – n↓ = 4.0,12 – 0,02 = 0,46 mol.
=> [NaOH] = 0,92M.
Ngoài ra các bạn có thể tham khảo thêm một số tài liệu sau:
Mầm Non Ánh Dương đã gửi tới bạn phương trình Al + H2O + NaOH → NaAlO2 + H2 được Mầm Non Ánh Dương biên soạn. Tài liệu đưa ra phương trình khi cho nhôm tác dụng với dung dịch NaOH, ở phương trình này các bạn học sinh thường rất hay nhầm lẫn trong quá trình viết sản phẩm.
Tài liệu này có thể giúp các bạn viết và cân bằng chính xác cũng như có thể mở rộng củng cố tính chất hóa học của Al, tính chất của NaOH thông qua các bài tập đi kèm
Chúc các bạn học tập tốt.
……………………..
Trên đây Mầm Non Ánh Dương đã giới thiệu tới bạn đọc tài liệu: Al + H2O + NaOH → NaAlO2 + H2. Để có kết quả cao hơn trong học tập, Mầm Non Ánh Dương xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Hóa học lớp 12, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà Mầm Non Ánh Dương tổng hợp và đăng tải.
Để thuận tiện cho các bạn học sinh trong quá trình trao đổi cũng như cập nhật thông tin tài liệu mới nhất, mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 12 để có thêm tài liệu học tập nhé
Bản quyền bài viết thuộc trường Mầm Non Ánh Dương. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Mầm Non Ánh Dương (mamnonanhduongvt.edu.vn)
Source: Mamnonanhduongvt.edu.vn
Category: Tin Tức