4HNO3 + Fe(OH)2 = 3H2O + NO2 + Fe(NO3)3 | Cân Bằng Phương Trình Hóa Học
HNO3 | axit nitric | dung dịch + Fe(OH)2 | Sắt(II) hidroxit | dung dịch = H2O | nước | lỏng + NO2 | nitơ dioxit | khí + Fe(NO3)3 | Sắt(III) nitrat | dung dịch, Điều kiện
Mục Lục
-
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
- Điều kiện phản ứng để HNO3 (axit nitric) tác dụng Fe(OH)2 (Sắt(II) hidroxit) là gì ?
- Làm cách nào để HNO3 (axit nitric) tác dụng Fe(OH)2 (Sắt(II) hidroxit)?
- Hiện tượng nhận biết nếu phản ứng xảy ra 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3 là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3 ?
- Giải thích chi tiết về các phân loại của phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
- Phản ứng oxi-hoá khử là gì ?
- Chuỗi phương trình hóa học có sử dụng 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
Cách viết phương trình đã cân bằng
 |
 |
 |
 |
 |
||||
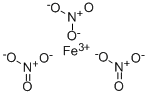
| 4HNO3 | + | Fe(OH)2 | → | 3H2O | + | NO2 | + | Fe(NO3)3 |
| axit nitric | Sắt(II) hidroxit | nước | nitơ dioxit | Sắt(III) nitrat | ||||
| Axit nitric | Iron(II) hydroxide | Nitrogen dioxide | Iron(III) nitrate | |||||
| (dung dịch) | (dung dịch) | (lỏng) | (khí) | (dung dịch) | ||||
| (không màu) | (lục nhạt) | (không màu) | (nâu đỏ) | (trắng) | ||||
| Axit | Bazơ | Muối | ||||||
| 63 | 90 | 18 | 46 | 242 |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
This post: 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
☟☟☟
Thông tin chi tiết về phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3 là Phản ứng oxi-hoá khử, HNO3 (axit nitric) phản ứng với Fe(OH)2 (Sắt(II) hidroxit) để tạo ra H2O (nước), NO2 (nitơ dioxit), Fe(NO3)3 (Sắt(III) nitrat) dười điều kiện phản ứng là Không có
Điều kiện phản ứng để HNO3 (axit nitric) tác dụng Fe(OH)2 (Sắt(II) hidroxit) là gì ?
Không có
Làm cách nào để HNO3 (axit nitric) tác dụng Fe(OH)2 (Sắt(II) hidroxit)?
cho dung dịch Fe(OH)2 tác dụng với dung dịch axit nitric
Nếu đang làm bài tập các bạn có thể viết đơn giản là HNO3 (axit nitric) tác dụng Fe(OH)2 (Sắt(II) hidroxit) và tạo ra chất H2O (nước), NO2 (nitơ dioxit), Fe(NO3)3 (Sắt(III) nitrat)
Hiện tượng nhận biết nếu phản ứng xảy ra 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3 là gì ?
có khí thoát ra
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thông tin
Phương Trình Điều Chế Từ HNO3 Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HNO3 (axit nitric) ra H2O (nước)
Xem tất cả phương trình điều chế từ HNO3 (axit nitric) ra H2O (nước)
Phương Trình Điều Chế Từ HNO3 Ra NO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HNO3 (axit nitric) ra NO2 (nitơ dioxit)
Xem tất cả phương trình điều chế từ HNO3 (axit nitric) ra NO2 (nitơ dioxit)
Phương Trình Điều Chế Từ HNO3 Ra Fe(NO3)3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HNO3 (axit nitric) ra Fe(NO3)3 (Sắt(III) nitrat)
Xem tất cả phương trình điều chế từ HNO3 (axit nitric) ra Fe(NO3)3 (Sắt(III) nitrat)
Phương Trình Điều Chế Từ Fe(OH)2 Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra H2O (nước)
Xem tất cả phương trình điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra H2O (nước)
Phương Trình Điều Chế Từ Fe(OH)2 Ra NO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra NO2 (nitơ dioxit)
Xem tất cả phương trình điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra NO2 (nitơ dioxit)
Phương Trình Điều Chế Từ Fe(OH)2 Ra Fe(NO3)3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra Fe(NO3)3 (Sắt(III) nitrat)
Xem tất cả phương trình điều chế từ Fe(OH)2 (Sắt(II) hidroxit) ra Fe(NO3)3 (Sắt(III) nitrat)
Giải thích chi tiết về các phân loại của phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
Click để xem tất cả câu hỏi có liên quan tới phương trình 4HNO3 + Fe(OH)2 → 3H2O + NO2 + Fe(NO3)3
Câu 1. Phản ứng hóa học
Cho các phản ứng sau:
(1). Fe(OH)2+HNO3 loãng →
(2). CrCl3+NaOH+Br2 →
(3). FeCl2+AgNO3(dư) →
(4). CH3CHO+H2 →
(5). Glucozơ+ AgNO3+NH3+H2O →
(6). C2H2+Br2 →
(7). Grixerol + Cu(OH)2 →
(8). Al2O3+HNO3(đặc, nóng) →
Số phản ứng xảy ra thuộc loại phản ứng oxi hóa khử là:
A. 6
B. 5
C. 7
D. 4
Xem đáp án câu 1
Câu 2. Oxi hóa – khử
Cho phương trình phản ứng sau:
aHNO3 + bFe(OH)2 —-> cH2O + dNO2 + e Fe(NO3)3.
Tỉ số hệ số a:d là
A. 1 : 3
B. 3 : 1
C. 4 : 3
D. 4 : 1
Xem đáp án câu 2
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗi
Source: Mamnonanhduongvt.edu.vn
Category: Phản ứng oxi-hoá khử